
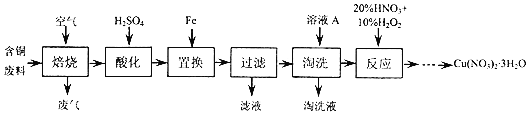

���� ��ҵ���ɺ�ͭ���ϣ�����Cu��CuS��CuSO4�ȣ��Ʊ�����ͭ���壬����ͨ��������պ�ͭ��������ͭ����ͭת��ΪCuO��SO2�����������ữ��������ͭ������������������û���Ӧ����ͭ�����˵õ���������ͭ������ˮ��ϴ�����20%��HNO3��0%��H2O2������Ӧ������Ũ�����������¶��Ը���26.4��C�ᾧ���ӡ���Ӧ��������Һ������Cu��NO3��2•3H2O��
��1��CuS���պ�������Ӧת��ΪCuO��SO2��
��2��������֪���˵õ���Һ��ҪΪ����������Һ��
��3����ϴ������ܾ���ǿ�����ԣ�
��4���١���Ӧ��һ�����õ��Լ���20%HNO3��10%H2O2���������ᣬ��������������������ͭ��������ͭ��
��������10%H2O����������2��ֻ��20%HNO3��ͭ��Ũ���ᷴӦ���ɶ����������壻
��5��ͼ���нᾧˮ������ܽ�����¶ȱ仯���߿�֪���¶ȸ���26.4��C�ӡ���Ӧ��������Һ������Cu��NO3��2•3H2O��
��� �⣺��ҵ���ɺ�ͭ���ϣ�����Cu��CuS��CuSO4�ȣ��Ʊ�����ͭ���壬����ͨ��������պ�ͭ��������ͭ����ͭת��ΪCuO��SO2�����������ữ��������ͭ������������������û���Ӧ����ͭ�����˵õ���������ͭ������ˮ��ϴ�����20%��HNO3��0%��H2O2������Ӧ������Ũ�����������¶��Ը���26.4��C�ᾧ���ӡ���Ӧ��������Һ������Cu��NO3��2•3H2O��
��1��CuS���պ�������Ӧת��ΪCuO��SO2����Ӧ�Ļ�ѧ����ʽΪ��2CuS+3O2$\frac{\underline{\;600��\;}}{\;}$2CuO+2SO2���ʴ�Ϊ��2CuS+3O2$\frac{\underline{\;600��\;}}{\;}$2CuO+2SO2��
��2��������֪���˵õ���Һ��ҪΪ����������Һ�������ˡ�������Һ�����ʵ���Ҫ�ɷ�ΪFeSO4���ʴ�Ϊ��FeSO4��
��3����ϴ������ܾ���ǿ�����ԣ�������ܽ�ͭ��
a��ϡ���ᣬ���ܺ�ͭ��Ӧ����aѡ��
b��Ũ�����ͭ�����²���Ӧ��������ˮ�ܽ�ų������ȣ����ͭ������Ӧ����b��ѡ��
c��ϡ�������������������ͭ����c��ѡ��
d��Ũ�������ܽ�ͭ����d��ѡ��
�ʴ�Ϊ��a��
��4���١���Ӧ��һ�����õ��Լ���20%HNO3��10%H2O2���������ᣬ��������������������ͭ��������ͭ��Ӧ�Ļ�ѧ����ʽΪ��Cu+H2O2+2HNO3=Cu��NO3��2+2H2O������������HNO3��H2O2�����ʵ���֮��Ϊ2��1���ʴ�Ϊ��2��1��
��������10%H2O����������2��ֻ��20%HNO3��ͭ��Ũ���ᷴӦ���ɶ����������壬��Ӧ�����ӷ���ʽΪ��Cu+4H++2NO3-=Cu2++2NO2��+2H2O��
�ʴ�Ϊ��Cu+4H++2NO3-=Cu2++2NO2��+2H2O��
��5��ͼ���нᾧˮ������ܽ�����¶ȱ仯���߿�֪���¶ȸ���26.4��C�ӡ���Ӧ��������Һ������Cu��NO3��2•3H2O���ӡ���Ӧ��������Һ������Cu��NO3��2•3H2O�ķ����ǣ�����Ũ�����������¶��Ը���26.4��C�ᾧ��
�ʴ�Ϊ������Ũ�����������¶��Ը���26.4��C�ᾧ��
���� ���⿼�����������ʡ������ᴿ�����ʷ����ʵ����̷����жϣ�ע��ʵ�����������Ӧ�ú��Լ������ã����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 ˫��ͬ������ѵ��ϵ�д�
˫��ͬ������ѵ��ϵ�д� �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �ں���������ʵ���Һ�У������ж����ѧƽ��森
�ں���������ʵ���Һ�У������ж����ѧƽ��森�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʵ��ٺ͢ھ���֤��K2Cr2O7��Һ�д�������ƽ�� | |
| B�� | ʵ�����˵�������ԣ�Cr2O72-��Fe3+ | |
| C�� | CrO42- ��Fe2+��������Һ�п��Դ������� | |
| D�� | ϡ��K2Cr2O7��Һʱ����Һ�и�����Ũ�Ⱦ���С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.5 mol/L | B�� | 0.25 mol/L | C�� | 0.1 mol/L | D�� | 1 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��״���£�22.4L���Ȼ�̼�ķ�����ԼΪNA | |
| B�� | 2.4g����þ��Ϊþ����ʱʧȥ�ĵ�����Ϊ0.2NA | |
| C�� | 16gO2��O3�Ļ��������������ԭ����ΪNA | |
| D�� | 1mo1•L-1��A1C13��Һ�У�C1-���ӵ���ĿΪ3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  | B�� |  | C�� |  | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

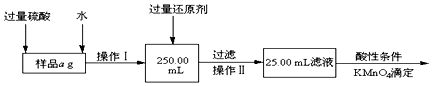
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com