

| 温度(℃) | 60 | 240 | 930 | 1000 |
| 残留固体质量(g) | 19.7 | 16.1 | 8.1 | 8.1 |
| 28.7g |
| 287g/mol |
| ||
| ||


科目:高中化学 来源: 题型:
 如图为铜锌原电池示意图,下列说法不正确的是( )
如图为铜锌原电池示意图,下列说法不正确的是( )| A、反应物是锌和稀硫酸 |
| B、铜片上不产生气泡 |
| C、电流计显示导线上电子由锌片流向铜片 |
| D、该装置能将化学能转变为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯元素的化合价升高 |
| B、Na2SO3是还原剂 |
| C、NaClO3发生氧化反应 |
| D、H2SO4被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
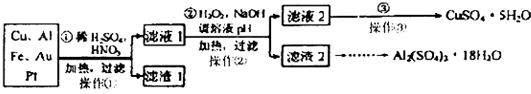

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com