
 某化学学习小组的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x的值.该组同学通过查阅资料查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
某化学学习小组的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x的值.该组同学通过查阅资料查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:分析 (1)配制100.00mL溶液时,需要的玻璃仪器有烧杯、玻璃棒、100mL容量瓶、胶头滴管;
(2)酸性溶液盛放在酸式滴定管中,碱性溶液盛放在碱性滴定管中;
酸性高锰酸钾溶液呈紫色,草酸和酸性高锰酸钾溶液发生氧化还原反应而使酸性高锰酸钾溶液褪色;
(3)由题给化学方程式:2MnO4-+5H2C2O4+6H+?2Mn2++10CO2↑+8H2O及数据可知,1.260g纯草酸晶体中含H2C2O4的物质的量为:0.1000 mol/L×10.00 mL×10-3 L/mL×$\frac{5}{2}$×$\frac{100mL}{25mL}$=0.0100 mol,则1.260gH2C2O4•xH2O中含H2O的物质的量为$\frac{1.260g-0.0100mol×90g/mol}{18g/mol}$=0.020 0 mol,根据草酸和水的物质的量之比确定x值;
(4)根据c(待测)=$\frac{c(标准).V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差,从而判断对测得的x值的影响.
解答 解:(1)配制100.00mL溶液时,需要的玻璃仪器有烧杯、玻璃棒、100mL容量瓶、胶头滴管,所以还需要的仪器是100mL容量瓶,故答案为:100mL容量瓶;
(2)酸性高锰酸钾溶液呈酸性,应该用酸式滴定管甲盛放;酸性高锰酸钾溶液呈紫色,草酸和酸性高锰酸钾溶液发生氧化还原反应而使酸性高锰酸钾溶液褪色,则终点现象为当滴入最后一滴酸性KMnO4溶液时,溶液由无色变为浅紫色,且半分钟内不褪色,
故答案为:甲;当滴入最后一滴酸性KMnO4溶液时,溶液由无色变为浅紫色,且半分钟内不褪色;
(3)由题给化学方程式:2MnO4-+5H2C2O4+6H+?2Mn2++10CO2↑+8H2O及数据可知,1.260g纯草酸晶体中含H2C2O4的物质的量为:0.1000 mol/L×10.00 mL×10-3 L/mL×$\frac{5}{2}$×$\frac{100mL}{25mL}$=0.0100 mol,则1.260gH2C2O4•xH2O中含H2O的物质的量为$\frac{1.260g-0.0100mol×90g/mol}{18g/mol}$=0.020 0 mol,草酸和水的物质的量之比等于其计量数之比=0.0100mol:0.0200mol=1:2,所以x=2,
故答案为:2;
(4)①若滴定终点时俯视滴定管刻度,造成V(标准)偏小,根据c(待测)=$\frac{c(标准).V(标准)}{V(待测)}$知,c(待测)偏小,由此所得n(H2C2O4)偏小,则n(H2O)偏大,x偏大,
故答案为:偏大;
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准).V(标准)}{V(待测)}$知,c(待测)偏大,由此所得n(H2C2O4)偏大,则n(H2O)偏小,x偏小,
故答案为:偏小.
点评 本题以滴定实验为载体考查物质组成,侧重考查学生实验操作、实验分析及判断能力,明确实验原理、实验操作规范性和方法是解本题关键,难点是误差分析,注意量筒和滴定管俯视时读数误差区别,为易错点,


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
 某化学学习小组的同学 依据氧化还原反应:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,可采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
某化学学习小组的同学 依据氧化还原反应:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,可采用滴定的方法测定FeSO4的质量分数,实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
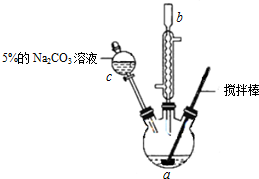
| 密度 | 沸点 | 溶解性 | ||
| 丙烯酸 | 1.05g/cm3 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
| 甲醇 | 0.79g/cm3 | 64.7℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
| 丙烯酸甲酯 | 0.95g/cm3 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
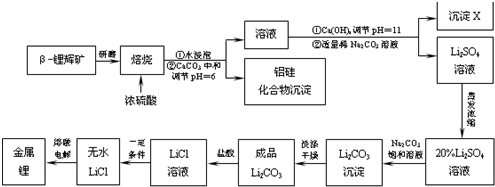
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测HCl溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

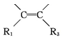 $→_{(2)Zn/H_{2}O}^{(1)O_{2}}$R1CHO+
$→_{(2)Zn/H_{2}O}^{(1)O_{2}}$R1CHO+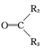
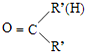 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$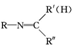 +H2O
+H2O  +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O
+H2O .
.  (写出其中一种的结构简式).
(写出其中一种的结构简式).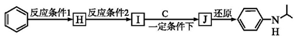 ,
, .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com