
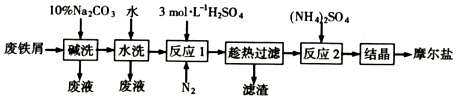
���� ����м��ϴ��ȥ���ۣ�ˮϴ��ȥ�����Һ����������ͱ�����������Ӧ������������ˮ���������ᷴӦ�������������������������Ӻ�����Ӧ�����������ӣ����������ױ����������뵪����װ���п����ž������ȹ��˵õ�����������Һ��������������Һ�м�������什ᾧ����Ħ���Σ�
��1�����Լ���Cu��CuSO4���γ�ԭ��أ��ӿ췴Ӧ���ʣ�
��2�������������ᷴӦ������������Fe����������Ӧ��������������
��3���ټ���������������������������������ӳ�����ȫ��
�ڳ�ȡ23.52g����Ī���Σ�����ˮ�����Һ���ֳ����ȷݣ�һ�ݼ���������BaCl2��Һ���õ���ɫ�������ᱵ������Ϊ13.98g�������ʵ���Ϊ$\frac{13.98g}{233g/mol}$=0.06mol������n��SO42-��=0.06mol��
��һ����0.2000mol•L-1K2Cr2O7������Һ�ζ�����Cr2O72-ǡ����ȫ����ԭΪCr3+ʱ��������Һ�����Ϊ25.00mL���������⣬
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n��Fe2+�� 0.2000mol•L-1��0.025L��
����n��Fe2+��=0.005 mol��6=0.03mol��
���ݵ���غ㣺n��NH4+��+2n��Fe2+��=2n��SO42-����n��NH4+��=0.06mol���ټ���n��H2O���������ʵ�����ȷ����ѧʽ��
��� �⣺��1�����Լ���Cu��CuSO4���γ�ԭ��أ��ӿ췴Ӧ���ʣ�
�ʴ�Ϊ��Cu��CuSO4��
��2�������к��������������Ʊ�ǰ��ȥ����������Һ��FeSO4��Һ�����������������������������������������������������ӷ���ʽΪ��Fe2O3+6H+=2Fe3++3H2O��Fe+2Fe3+=3Fe2+��
�ʴ�Ϊ��Fe2O3+6H+=2Fe3++3H2O��Fe+2Fe3+=3Fe2+��
��3��������������������立�Ӧ�������ᱵ���������������������������������������㣬����Һ�д�����������ӣ��ʼ������������������������������ɣ�֤�����������������������Ϊ���ټ���һ��Ba��OH��2��Һ�����������µij�������˵����������������
�ʴ�Ϊ���ټ���һ��Ba��OH��2��Һ�����������µij�����
�ڸ������⣬��ɫ���������ʵ���Ϊ $\frac{13.98g}{233g/mol}$=0.06moln��SO42-��=0.06mol��
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n��Fe2+�� 0.2000mol•L-1��0.025L��
����n��Fe2+��=0.005 mol��6=0.03mol��
���ݵ���غ㣺n��NH4+��+2n��Fe2+��=2n��SO42-����n��NH4+��=0.06mol��
n��H2O��=$\frac{\frac{25.52g}{2}-0.06mol��96g/mol-0.03mol��56g/mol-0.06mol��18g/mol}{18g/mol}$=0.18 mol��
����n��SO42-����n��Fe2+����n��NH4+����n��H2O��=0.06mol��0.03mol��0.06mol��0.18mol=2��1��2��6������Ī���εĻ�ѧʽΪ��NH4��2Fe��SO4��2•6H2O[��NH4��2SO4•FeSO4•6H2O]��
�ʴ�Ϊ��Ī���εĻ�ѧʽΪ��NH4��2Fe��SO4��2•6H2O��
���� ������Ī���ε��Ʊ�Ϊ���壬��������ˮ�⡢��ѧ���ԭ��ء����ʷ����ᴿ���й�ʵ������Լ��ۺ�����֪ʶ����������������Ŀ�Ѷ��еȣ��������ʵ����ʡ��Ʊ�ԭ������ѧ���㼼��Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬ע��Ԫ�ػ�����֪ʶ��Ӧ�ã�


 ���ʿ��ÿ��ֳɳ�ϵ�д�
���ʿ��ÿ��ֳɳ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | X��Y��Z�ĵ縺�Դ�С˳����Z��Y��X | |
| B�� | WY2�����ЦҼ���м�����Ŀ֮����2��1 | |
| C�� | W��X��Y��Z��ԭ�Ӱ뾶��С˳����X��Y��Z��W | |
| D�� | W��Z�γɵķ��ӵĿռ乹���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����C��D�����ʵ��� | B�� | ���������뺤�� | ||
| C�� | ����B�����ʵ��� | D�� | ����A��B�����ʵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����Ƽ�Ĺ��չ�����Ӧ���������ܽ�ȵIJ��� | |
| B�� | ��ȥKNO3�л��ӵ�NaCl�������ؽᾧ�ķ���������Ϊ�Ȼ�����ˮ���ܽ�ȴ� | |
| C�� | ����Ͳ��ȡ20mL 0.5 mol•L-1H2SO4���ձ��У���ˮ80mL�����Ƴ�0.1 mol•L-1H2SO4��Һ | |
| D�� | ��������Na2O��Na2O2�ֱ���뵽��̪��Һ�У�������Һ��Ϊ��ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ����� | ʵ������ | ���� |
| A | ��FeBr2��Һ��ͨ������Cl2 | ��Һ��dz��ɫ��Ϊ��ɫ | �����ԣ�Cl2��Br2 |
| B | ��Na2SO3��Һ�еμ����� | ��������� | �ǽ����ԣ�Cl��S |
| C | ��pH=3��HA��HB��Һ�зֱ��ˮϡ����100�� | pH��HA����pH��HB�� | ���ԣ�HA��HB |
| D | ���ؾ�ʯ�м��뱥��̼������Һ | �ؾ�ʯ���ܽ� | �ܶȻ���Ksp��BaCO3����Ksp��BaSO4�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | PH��ͬ�Ģ�CH3COONa ��NaHCO3 ��NaClO������Һc��Na + �����٣��ڣ��� | |
| B�� | ����0.1mol/LNa2CO3��Һ��CO3 2- ��ˮ��̶Ⱥ���Һ��PH������ | |
| C�� | NaCl��Һ��CH3COONH4��Һ�������ԣ�����Һ��ˮ�ĵ���̶���ͬ | |
| D�� | ��Na2CO3��Һ�е����̪��Һ����Һ��죬ԭ���ǣ�CO3 2-+H2O?HCO3-+OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�44g CO2�к���2NA���м� | |
| B�� | 1mol•L-1NaCl��Һ����NA��Na+ | |
| C�� | 0.5mol Cu������Ũ���ᷴӦ��������22.4LNO2 | |
| D�� | ������Һ��������Ӧ������Ӧ������1mol������ת�Ƶĵ�����ĿΪ2NA�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������Һ�Լ��ԣ�SO32-+2H2O=H2SO3+2OH- | |
| B�� | ��NH4��2FeSO4��Һ�����NaOH��Һ�����ȡ������������Fe2++2OH-=Fe��OH��2 | |
| C�� | NaAlO2��Һ��ͨ�����CO2��ȡ����������2AlO2-+CO2+3H2O=2Al��OH��3+CO32- | |
| D�� | ��������HI����Һ��Fe2O3+6H++2I-=2Fe2++I2+3H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com