
| △C |
| △t |
| △C |
| △t |
| 1.2mol/L |
| 2min |
| ||
| 2min |
| 1.6 |
| 2 |
| 2mol+2mol |
| 0.4mol+1.2mol+2.4mol |


科目:高中化学 来源: 题型:
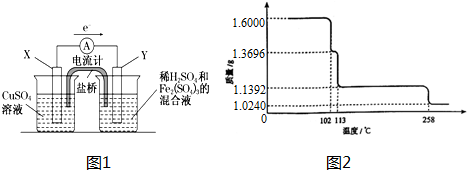
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 |
| B、因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
| C、铁制品应该连接在直流电源的负极 |
| D、镀锌层破损后即对铁制品失去保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡时,B的转化率为80% | ||
B、平衡时,容器内压强为原来的
| ||
| C、平衡时,C的浓度为0.5mol/L | ||
| D、A的平均反应速率为0.30mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18.0L |
| B、27.0L |
| C、31.4L |
| D、33.6L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com