
(8分)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。
![]() (1)某温度下,SO3(g)
(1)某温度下,SO3(g)![]() SO2(g)+1/2O2(g);△H= +98 kJ?mol-1。开始时在100L的密闭容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=
SO2(g)+1/2O2(g);△H= +98 kJ?mol-1。开始时在100L的密闭容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=
![]() (2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 。
2SO3(g)达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 。
![]() A.保持温度和容器体积不变,充入2mol SO3
A.保持温度和容器体积不变,充入2mol SO3
![]() B.保持温度和容器体积不变,充入2mol N2
B.保持温度和容器体积不变,充入2mol N2
![]() C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
![]() D.保持温度和容器内压强不变,充入1mol SO3
D.保持温度和容器内压强不变,充入1mol SO3
![]() E.升高温度
E.升高温度
![]() F.移动活塞压缩气体
F.移动活塞压缩气体
![]() (3)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
(3)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
![]() 。
。

![]()
![]()
(4)若通入SO2的速率为2.24L/min(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为 mL/min
科目:高中化学 来源:潮州市2008年高考第二次模拟测试、化学试题 题型:058
工业上生产红矾(重铬酸钠Na2Cr2O7)的原料为铬铁矿(可视为FeO·Cr2O3、还含有Al2O3、SiO2).某研究性学习小组模拟工业生产红矾的原理制备红矾,并以红矾为原料制备少量的重铬酸钾(K2Cr2O7).实验流程为:
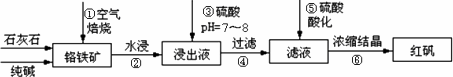
已知焙烧时Al2O3、SiO2发生反应:
SiO2+CaCO3![]() CaSiO3+CO2↑ Al2O3+Na2CO3
CaSiO3+CO2↑ Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
焙烧时铬铁矿发生反应:
4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1)步骤①应将反应物装在________(填仪器名称)中焙烧;步骤④需要用到的玻璃仪器________________.
(2)步骤③用硫酸将溶液的pH调至7~8,目的是________________;并写出有关的离子方程式________________.
(3)滤液加入硫酸酸化过程中,溶液由黄色变为橙色,反应的离子方程式为________________.
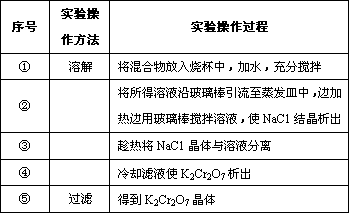
(4)将红矾钠与KCl固体1∶2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体.②③④的实验操作方法分别是________________.
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省八校高三第二次联考理综化学试卷(解析版) 题型:填空题
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3,以及SiO2、Al2O3等杂质)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下:
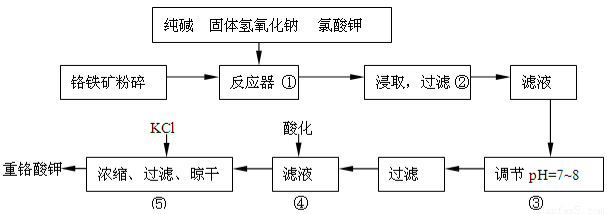
反应器中主要发生的反应为:
Ⅰ.FeO·Cr2O3+NaOH+KClO3→Na2CrO4+Fe2O3+H2O+KCl(未配平)
Ⅱ.Na2CO3+SiO2 Δ Na2SiO3+CO2↑
Ⅲ.Al2O3+2NaOH Δ 2NaAlO2+H2O
在步骤③中将溶液pH调节到7~8可以将SiO32-和AlO2-转化为相应的沉淀除去。
(1)在反应Ⅰ中氧化剂是________,若有245g KClO3 参加反应,则转移的电子数为_____________。
(2)反应器中生成的Fe2O3又可和Na2CO3反应得到一种摩尔质量为111g/mol的化合物,能强烈水解,在操作②生成沉淀而除去,写出生成该化合物的化学反应方程式_____________________________
___________________________。
(3)操作④目的是将CrO42-转化为Cr2O72-,其现象为__________________________,离子方程式为_______________________________________。
(4)请选用合适的方法进一步提纯粗产品重铬酸钾__________(填字母)
A.重结晶???????? B.萃取分液???????? C.蒸馏
(5)分析产品中K2Cr2O7的纯度是利用硫酸酸化的K2Cr2O7将KI氧化成I2,然后利用相关物质测出I2的量从而获得K2Cr2O7的量,写出酸化的K2Cr2O7与KI反应的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上生产红矾(重铬酸钠Na2Cr2O7)的原料为铬铁矿(可视为FeO?Cr2O3、还含有Al2O3、SiO2)。某研究性学习小组模拟工业生产红矾的原理制备红矾,并以红矾为原料制备少量的重铬酸钾(K2Cr2O7)。实验流程为:
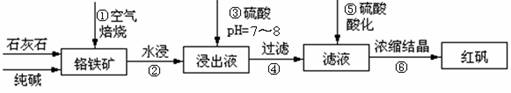
已知焙烧时Al2O3、SiO2发生反应:
SiO2+CaCO3![]() CaSiO3+CO2↑ Al2O3+Na2CO3
CaSiO3+CO2↑ Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
焙烧时铬铁矿发生反应:
4FeO?Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1)步骤①应将反应物装在_______(填仪器名称)中焙烧;步骤④需要用到的玻璃仪器____。
(2)步骤③用硫酸将溶液的pH调至7~8,目的是 ;
并写出有关的离子方程式 。
(3)滤液加入硫酸酸化过程中,溶液由黄色变为橙色,反应的离子方程式为 。
(4)将红矾钠与KCl固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体。②③④的实验操作方法分别是_______________。
| 序号 | 实验操作方法 | 实验操作过程 |
| ① | 溶解 | 将混合物放入烧杯中,加水,充分搅拌 |
| ② | 将所得溶液沿玻璃棒引流至蒸发皿中,边加热边用玻璃棒搅拌溶液,使NaC1结晶析出 | |
| ③ | 趁热将NaC1晶体与溶液分离 | |
| ④ | 冷却滤液使K2Cr2O7析出 | |
| ⑤ | 过滤 | 得到K2Cr2O7晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com