
下列说法正确的是( )
A. 含有非极性键的分子不一定是共价化合物。
B. 分子间作用力比化学键弱得多,但它对物质的熔点、沸点有较大的影响,而对溶解度无影响。
C. 根据π键的成键特征判断C=C键能是C—C键能的2倍。
D. H2O中心原子采取sp杂化。
 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
已知:将Cl2通入适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且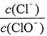
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是( )
A.若某温度下,反应后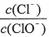 =11,则溶液中
=11,则溶液中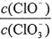 =
=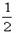
B.参加反应的氯气的物质的量等于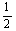 a mol
a mol
C.改变温度,反应中转移电子的物质的量ne的范围: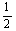 a mol≤ne≤
a mol≤ne≤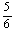 a mol
a mol
D.改变温度,产物中KC1O3的最大理论产量为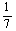 a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中元素均为中学化学中常见短周期元素,根据表中信息,下列说法不正确的是
| 元素代号 | X | Y | Z | W | N |
| 原子半径/nm | 0.186 | 0.074 | 0.102 | 0.099 | 0.160 |
| 主要化合价 | +1 | -2 | -2、+6 | +7、-1 | +2 |
A.常温下单质与水反应速率:X > N
B.最高价氧化物对应水化物酸性:W > Z
C.X 与W形成的化合物是共价化合物
D.X和Y的单质在一定条件下反应可生成一种淡黄色的固体化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求完成下列问题。
(1)写出NH3的电子式: 。 (2) 写出基态Cr原子的简化电子排布式 :_______。
(3)写出基态 Mg2+的电子排布图: 。 (4) 写出Zn原子的价电子排布式 :____________。
(5)将Al、Si、P、S的第一电离能由小到大排列为 。
(6) 指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:________、________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大。
B. 恒容容器中平衡体系A(g)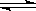 2B(g)中增加A的物质的量,A的转化率增大。
2B(g)中增加A的物质的量,A的转化率增大。
C. 一定条件下反应2AB(g) 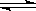 A2(g)+B2(g), 当容器中各组分的体积分数不随时间变化,说明体系达到平衡状态。
A2(g)+B2(g), 当容器中各组分的体积分数不随时间变化,说明体系达到平衡状态。
D. 已知反应A2(g)+2B2(g) 2AB2(g)△H <0, 升高温度,正向反应速率增加,逆向反应速率减小。
2AB2(g)△H <0, 升高温度,正向反应速率增加,逆向反应速率减小。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某化学反应的平衡常数表达式为K=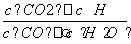 ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是
A.该反应的化学方程式是:CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO为0.4 mol时,该反应为平衡状态
D.某温度下,如果平衡浓度符合下列关系式: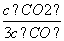 =
=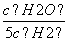 ,判断此时的温度是1000 ℃
,判断此时的温度是1000 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸。
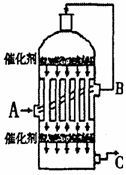 (1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为: ,该反应在 中进行(填仪器名称)。
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为: ,该反应在 中进行(填仪器名称)。
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用了多层催化剂
且有热交换器的 (填仪器名称)中进行反应。在如图所示的装置中, C处流出的气体有 ;SO3进入 (填仪器名称)用 吸收,得到浓硫酸或发烟硫酸。
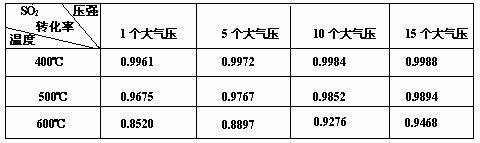
(3)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下
表信息,结合工业生产实际,选择最合适的生产条件是 。
 |
(4)现在欲提高SO2的反应速率和转化率,下列措施可行的是 。
A、向装置中通入氮气且保持体积不变 B、向装置中通入氧气且保持体积不变
C、添加更多的催化剂 D、降低温度,及时转移SO3
(5)由吸收塔排出的尾气中有SO2的含量如果超过500μL/ L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com