
【题目】下图是实验室对煤进行干馏的装置图,回答下列问题:

(1)指出图中仪器名称:c______,d______。
(2)仪器d的作用是______,c中液体有______和______,其中无机物里溶有_____,可用_____检验出来。有机物可以通过______的方法使其中的重要成分分离出来。
(3)e处点燃的气体的主要成分有_______,火焰的颜色为_______。
【答案】(1)酒精喷灯 烧杯
(2)盛装冷水对蒸气进行冷却 粗氨水 煤焦油 氨 酚酞溶液 分馏
(3)H2、CH4、CH2=CH2、CO 淡蓝色
【解析】
根据煤干馏的主要产品,b中得到的应是焦炭,c中得到的应是粗氨水和煤焦油,e处点燃的应是焦炉气。其中粗氨水中溶有氨,呈碱性,可用酚酞溶液等检验;煤焦油主要是苯、甲苯、二甲苯的混合物,应用分馏的方法分离;焦炉气的主要成分有CH4、CO、H2、CH2=CH2,燃烧时呈淡蓝色火焰。
(1)根据仪器的构造可知,仪器c为U形管;仪器d为烧杯;
(2)仪器d的作用是盛装冷水对蒸气进行冷却,c中液体有粗氨水和煤焦油,其中无机物里溶有近,可用酚酞溶液检验出来。有机物可以利用沸点的不同通过蒸馏(或分馏)的方法使其中的重要成分分离出来;
(3)e处点燃的气体的主要成分有H2、CH4、C2H4、CO,火焰的颜色为淡蓝色。


科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示

已知:(1)Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13;
(2)铅与冷盐酸、冷硫酸几乎不起作用。
请回答下列问题:
(1)写出步骤①“转化”的化学方程式_________________________________
(2)步骤②“过滤1”后所得滤渣的主要成分为_____________
(3)步骤③“酸溶”,最适合选用的酸为___________,为提高酸溶速率,可采取的措施是____________________________________(任意写出一条)
(4)若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5mol·L-1,则此时c(SO42-)=_________ mol·L-1
(5)从原子利用率的角度分析该流程的优点为____________________________________。
(6)步骤⑥“合成”三盐的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为从海带中提取碘的工业生产过程,有关说法错误的是

A.因海水中蕴藏着极其丰富的碘元素,所以工业上也可以直接用海水来提取碘元素
B.碱化操作时,加入NaOH溶液的原因是在碱性溶液中,可溶性有机质可形成沉淀
C.在实验室进行氧化操作时,加入的氧化剂可以是新制氯水、双氧水等
D.在实验室进行过滤操作时,需要用到玻璃仪器有玻璃棒、烧杯、漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明铝的金属性比镁弱的实验事实是( )
A.镁与冷的浓硫酸反应,铝与冷的浓硫酸不反应
B.铝的原子半径比镁小
C.Al(OH)3能溶于NaOH溶液,而Mg(OH)2不能
D.银的金属光泽不如镁显著
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于同主族元素的说法不正确的是
A.自上而下原子半径逐渐增大
B.自上而下金属性逐渐增强
C.自上而下非金属性逐渐减弱
D.自上而下原子得电子能力逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家利用下列装置图成功地实现了CO2和H2O合成CH4。下列叙述错误的是

A. 电池工作时,实现了将太阳能转化为电能
B. 电路中转移1mol的电子时, 有1mol H+ 透过质子交换膜从左向右移
C. 铜电极为正极,电极反应式为CO2-8e-+8H+=CH4+2H2O
D. 为提高该人工光合系统的工作效率,可向装置中加入少量稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水提镁的主要流程如下,下列说法正确的是

①试剂M是盐酸 ②流程中的反应全部都是非氧化还原反应
③操作b只是过滤 ④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤采用电解法冶炼镁是因为镁很活泼
A. ①②③④⑤ B. ②③ C. ④⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用如图所示装置制备、干燥、收集气体的是( )

A. 以MnO2、浓盐酸为原料,制备Cl2
B. 以浓氨水、生石灰为原料,制备NH3
C. 以Na2SO3固体、质量分数为70%的浓硫酸为原料,制备SO2
D. 以Cu、稀硝酸为原料,制备NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、CO(NH2)2 (尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。

(1)如图表示用石墨作电极,在一定条件下电解饱和食盐水制取Cl2时,阳极上产生也会产生少量的ClO2的电极反应式:________________________________;电解一段时间,当阴极产生标准状况下气体112 mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为________mol。
(2)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(3)步骤Ⅱ合成N2H4·H2O的装置如下图所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_________________;使用冷凝管的目的是_________________________________。
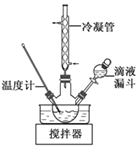
(4)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3,欲测定亚硫酸钠产品的纯度设计如下实验方案,并进行实验。准确称取所得亚硫酸钠样品m g于烧杯中,加入适量蒸馏水配成100 mL待测溶液。移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1酸性KMnO4标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(假设杂质不反应)。样品中亚硫酸钠的质量分数为__________(用含m、c、V的代数式表示)。某同学设计的下列滴定方式中,合理的是________(夹持部分略去)(填字母序号)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com