
将5mol/L的Mg(NO3)2溶液amL稀释bmL,稀释后NO的物质的量浓度为
A.5a/b mol/L B.10a/b mol/L C.b/5a mol/L D.a/b mol/L
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届宁夏银川市高三上学期第三次月考化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式 。
(2)根据元素周期律,原子半径Ga As,第一电离能Ga As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为 ,其中As的杂化轨道类型为 。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是 。
(5)GaAs的熔点为1238℃,密度为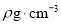 ,其晶胞结构如图所示。
,其晶胞结构如图所示。
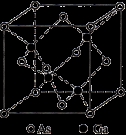
该晶体的类型为 。Ga与As的摩尔质量分别为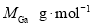 和
和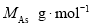 ,原子半径分别为
,原子半径分别为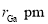 和
和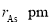 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则
,则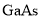 晶胞中原子的体积占晶胞体积的百分率为 。(已知1m=1012pm)
晶胞中原子的体积占晶胞体积的百分率为 。(已知1m=1012pm)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一上月考三化学卷(解析版) 题型:选择题
常温下,在溶液中可以发生反应:X+2Y3+==2Y2++X2+,对下列叙述的判断正确的是( )
①X被氧化 ②X是氧化剂 ③X具有还原性 ④Y2+是氧化产物
⑤Y2+具有还原性 ⑥Y3+的氧化性比X2+的氧化性强
A.②③④⑥ B.①③④⑤ C.①③⑤⑥ D.①②⑤⑥
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上期中化学卷(解析版) 题型:填空题
按要求完成下列各题
(1)写出碳酸氢钠在水溶液中的电离方程式
(2)写出下列反应的离子方程式:
①氧化镁加入稀硫酸中
②氨水中加入稀盐酸
③把二氧化碳通入足量的澄清石灰水中
④向Ba(OH)2溶液中逐滴滴入NaHSO4溶液至Ba2+恰好沉淀完全
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上期中化学卷(解析版) 题型:选择题
下列反应能用H++OH-=H2O表示的是
A.氢氧化铜和稀盐酸 B.Ba(OH)2 溶液滴入稀硫酸中
C.澄清的石灰水和稀硝酸反应 D.醋酸和氢氧化钠反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上期中化学卷(解析版) 题型:选择题
有下列仪器:①漏斗;②容量瓶;③蒸馏烧瓶;④天平;⑤分液漏斗;⑥量筒;⑦燃烧匙。其中常用于分离物质的仪器是
A.①③④ B.①②⑥ C.①③⑤ D.③④⑦
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:选择题
氨氮废水中 的氮元素多以NH4+和NH3·H2O的形式存在,在一定条件下,NH4+经过两步反应被氧化成NO3?,两步反应的能量变化示意图如下:
的氮元素多以NH4+和NH3·H2O的形式存在,在一定条件下,NH4+经过两步反应被氧化成NO3?,两步反应的能量变化示意图如下:
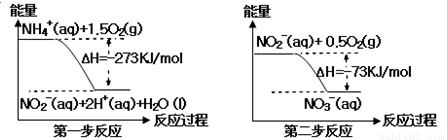
下列说法合理的是( )
A.该反应的催化剂是NO2?
B.升高温度,两步反应速率均加快,有利于NH4+ 转化成NO3?
C.在第一步反应中,当溶液中水的电离程度不变时,该反应即达平衡状态
D.1 mol NH4+在第一步反应中与1 mol NO2-在第二步反应中失电子数之比为1:3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上期中化学试卷(解析版) 题型:选择题
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是:
A.不是在室温下 B.弱酸溶液与强碱溶液反应
C.强酸溶液与强碱溶液反应 D.二元强酸溶液和一元强碱溶液反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:填空题
甲醇燃料电池被认为是21世纪电动汽车候选动力源
(1)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2
已知H2(g)+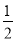 O2(g)=H2O(g) △H =-241.8 kJ·mol-1,则反应②的△H2= 。
O2(g)=H2O(g) △H =-241.8 kJ·mol-1,则反应②的△H2= 。
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) CH3OH(g),现实验室模拟该反应并进行分析,下图是该反应在不同温度下CO的转化率随时间变化的曲线
CH3OH(g),现实验室模拟该反应并进行分析,下图是该反应在不同温度下CO的转化率随时间变化的曲线
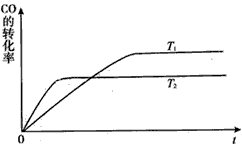
①该反应的焓变△H__________0(填“>” “<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1__________K2(填“>”“<”或“=”)
③现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2,测得CO 和CH 3OH(g)的浓度随时间变化如图所示。

从反应开始到平衡,CO的平均反应速率v(CO)=__________,该反应的平衡常数为K=__________
④恒容条件下,达到平衡后,下列措施中能使n(CH3OH)/n(CO )增大的有__________
A.升高温度 B.充入He(g)
C.再充入1molCO 和3molH2 D.使用催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com