
| A. | Fe3+ Cl -Na+SO42- | B. | MnO4-K+Cl-Na+ | ||
| C. | NH4+SO42-OH-Na+ | D. | CO32- HCO3- K+ Na+ |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃做防火材料 | B. | 二氧化硅不和任何酸反应 | ||
| C. | 可用石英坩埚加热氢氧化钠固体 | D. | 光导纤维的主要成分是硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
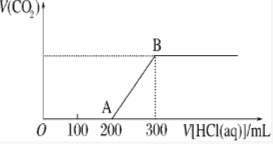 将1.46g NaOH和Na2CO3混合物配成溶液,向溶液中滴加0.1mol•L-1稀盐酸.加入盐酸的体积和生成CO2的物质的量的关系如图所示,则混合物中NaOH和Na2CO3的物质的量之比为( )
将1.46g NaOH和Na2CO3混合物配成溶液,向溶液中滴加0.1mol•L-1稀盐酸.加入盐酸的体积和生成CO2的物质的量的关系如图所示,则混合物中NaOH和Na2CO3的物质的量之比为( )| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯与等物质的量氯化氢加成只生成一种产物 | |
| B. | 1mol丙烯完全燃烧的耗氧量为4.5mol | |
| C. | 聚丙烯的链节是-CH2-CH2-CH2- | |
| D. | 1mol丙烯和1mol聚丙烯完全燃烧放出CO2的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,7.8g Na2O2中含有的阴离子的数目为0.2NA | |
| B. | 1mol/L的CaCl2溶液中含有的Cl-为2NA | |
| C. | 1mol金属钠与足量氧气反应生成Na2O或Na2O2时,失去的电子数目均为NA | |
| D. | 常温常压下,18g水中含有的水分子数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com