过氧化钠样品中常含有少量碳酸钠杂质.某研究性学习小组设计了下面的装置来测定样品中过氧化钠的质量分数.(图中夹持装置略去)
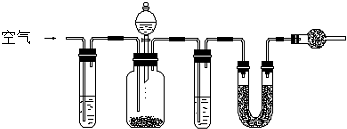
实验步骤如下:按图组装仪器,并检查其气密性;称量盛有碱石灰的装置D的质量;称量一定质量的原样品,将其放入装置B中;通过分液漏斗注入足量稀硫酸,并缓缓鼓入足量空气;再次称量装置D的质量.请回答:
(1)装置C中的试剂是
.
(2)写出装置A中发生反应的离子方程式:
.
(3)装置E中碱石灰的作用是
.
(4)若改变以下设计,可能导致过氧化钠质量分数偏低的是
(填序号).
①去掉装置A ②去掉装置C ③去掉装置E ④用稀盐酸代替稀硫酸.



