
工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解生产CO2。主要反应如下:
C+O2→CO2 ①, CaCO3→CO2↑+CaO ②
(1)含碳酸钙95%的石灰石2.0 t按②完全分解(设杂质不分解),可得标准状况下CO2的体积为_________________m3。
(2)纯净的CaCO3和焦炭按①②完全反应,当窑内配比率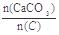 =2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
=2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
(3)某次窑气成分如下:O2 0.2%,CO 0.2%,CO2 41.6%,其余为N2。则此次窑内配比率 为何值?
为何值?
(1)425.6 (2)44.4%(3)1.90
【解析】
试题分析:(1)根据反应②的化学方程式可知CO2的物质的量等于CaCO3的物质的量,所以标准状况下CO2的体积为:2.0×95%×106g÷100g/mol×22.4L/mol=425600L,即425.6m3。
(2)设n(C)=1mol,则n(CaCO3)=2.2mol,当空气中的O2与C完全反应时,所得窑气中CO2体积分数最大,1molC燃烧生成1mol CO2,2.2mol CaCO3分解生成2.2mol CO2,所以CO2的体积分数=(1+2.2)÷(1+2.2+4)×100%=44.4%
(3)设窑气为100mol,则n(N2)=100mol-41.6mol-0.2mol-0.2mol=58mol,所以反应前O2的总量为:58mol÷4=14.5mol,参加反应的O2为:14.5mol-0.2mol=14.3mol,2C+O2=2CO,生成0.2mol
CO需O2 0.1mol;C+O2=CO2,与C反应生成CO2的O2为:14.3mol-0.1mol=14.2mol,生成的CO2为14.2mol;CaCO3分解生成的CO2为:41.6mol-14.2mol=27.4mol,则CaCO3的物质的量为27.4mol,所以窑内配比率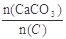 为:27.4mol:(0.2mol+14.2mol)=1.90
为:27.4mol:(0.2mol+14.2mol)=1.90
考点:本题考查混合物的计算。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
| m |
| 100 |
| m |
| 12 |
| m |
| 100 |
| m |
| 12 |
| n(CaCO3) |
| n(C) |
| n(CaCO3) |
| n(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解产生CO2。主要反应如下:①C+O2→ CO2,②CaCO3→CO2↑+CaO。
⑴含碳酸钙95%的石灰石2 t,按②完全分解(设杂质不分解),可得标准状况下CO2的体积为_______m3。
⑵按①、②完全反应,若所得CO2的体积为11.2 m3(标准状况),则需要固体物质的质量m为 。
⑶某次窑气成分如下:O2 4.0%,CO 2.0 %,CO2 40.0%,其余为N2(CaCO3和C在石灰窑中完全反应)。则此次窑内配比率n(CaCO3)/n(C)为何值?
查看答案和解析>>
科目:高中化学 来源:2010-2011学年上海市十校高三下学期第二次联考化学试卷 题型:填空题
工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解生产CO2。主要反应如下:
C+O2→CO2 ①, CaCO3→CO2↑+CaO ②
(1)含碳酸钙95%的石灰石2.0 t按②完全分解(设杂质不分解),可得标准状况下CO2的体积为_________________m3。
(2)纯净的CaCO3和焦炭混合物m g在石灰窑中完全反应,所得CO2的物质的量范围是_______________________。
(3)纯净的CaCO3和焦炭按①②完全反应,当窑内配比率 =2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
=2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
(4)某次窑气成分如下:O2 0.2%,CO 0.2%,CO2 41.6%,其余为N2。则此次窑内配比率 为何值?
为何值?
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解生产CO2。主要反应如下:C+O2→CO2 ①, CaCO3→CO2↑+CaO ②
53.含碳酸钙95%的石灰石2.0 t按②完全分解(设杂质不分解),可得标准状况下CO2的体积为_________________m3。
54.纯净的CaCO3和焦炭按①②完全反应,当窑内配比率![]()
![]() =2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
=2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
55.某次窑气成分如下:O2 0.2%,CO 0.2%,CO2 41.6%,其余为N2。则此次窑内配比率![]() 为何值?
为何值?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com