
| A. | 能使红色石蕊试纸变蓝色的溶液中:K+、CO32-、NO3-、AlO2- | |
| B. | 滴入酚酞溶液显红色的溶液中:K+、Na+、Cu2+、SO42- | |
| C. | 由水电离产生的(H+)=10-13mol/L的溶液中:Na+、Cl-、NO3-、CH3COO- | |
| D. | pH=l 的溶液中:Na+、Fe2+、NO3-、Cl- |
分析 A.能使红色石蕊试纸变蓝色的溶液,显碱性;
B.滴入酚酞溶液显红色的溶液,显碱性;
C.由水电离产生的(H+)=10-13mol/L的溶液,为酸或强碱溶液;
D.pH=l 的溶液,显酸性,离子之间发生氧化还原反应.
解答 解:A.能使红色石蕊试纸变蓝色的溶液,显碱性,该组离子之间不反应,可大量共存,故A正确;
B.滴入酚酞溶液显红色的溶液,显碱性,不能大量存在Cu2+,故B错误;
C.由水电离产生的(H+)=10-13mol/L的溶液,为酸或强碱溶液,酸溶液中不能大量存在CH3COO-,故C错误;
D.pH=l 的溶液,显酸性,H+、Fe2+、NO3-发生氧化还原反应,不能共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解的反应、氧化还原反应的判断,题目难度不大.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:选择题

| A. | 溶液酸性越强,R 的降解速率越小 | |
| B. | R的起始浓度越小,降解速率越大 | |
| C. | 在0~50 min之间,pH=2和PH=7时R的降解百分率相等 | |
| D. | 在20~25 min之间,pH=10 时R的平均降解速率为0.04 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L CO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | 标准状况下,22.4 L氖气含有原子数为NA | |
| C. | 物质的量浓度为2 mol/L的BaCl2溶液中,含有Cl-个数为4NA | |
| D. | 标准状况下,11.2 L H2O含有0.5NA分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
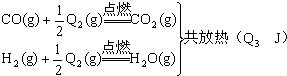
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子的还原性强弱:I->Fe2+>Br- | |
| B. | 当a≥b时,发生的离子反应:2I-+Br2═I2+2Br- | |
| C. | 当5a=4b时,反应后的离子浓度之比:c(Fe2+):c(Fe3+):c(Br-)=1:1:5 | |
| D. | 当3a≤2b时,发生的离子反应:2Fe2++2I-+2Br2═2Fe3++I2+4Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温、常压下,11.2 L N2含有的分子数为0.5NA | |
| B. | 标准状况下,22.4 L H2和O2的混合气体所含分子数为NA | |
| C. | 在标准状况下,1 mol H2和1 mol H2O所占的体积都约为22.4 L | |
| D. | 标准状况下,1 mol CCl4的体积是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用100毫升量筒量取8.5毫升水 | |
| B. | 在台式天平的左右盘中各放一纸片,调平后,左盘放药品,右盘放砝码并调整游码,称取一定质量的氢氧化钠固体 | |
| C. | 加热试管前,用抹布将试管外壁擦干,以防试管受热不匀而破裂 | |
| D. | 在看到氢气发生器中稀硫酸与锌粒反应开始产生较多气泡时,即可在气体导出管口点燃氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,等质量的N2和CO气体的原子数均为2NA | |
| B. | 在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA | |
| C. | 含有3mol离子的过氧化钠固体和足量的水反应,电子转移数为NA | |
| D. | 标准状况下,2.24 L CCl4含有的分子数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com