
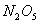 是一种新型硝化剂,在一定温度下可发生以下反应:
是一种新型硝化剂,在一定温度下可发生以下反应:
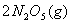

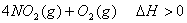
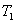 温度时,向密闭容器中通入
温度时,向密闭容器中通入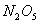 ,部分实验数据见下表:
,部分实验数据见下表:
|
| 0 | 500 | 1000 | 1500 |
|
| 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是( )
A. 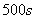 内
内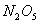 分解速率为
分解速率为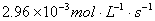
B. 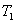 温度下的平衡常数
温度下的平衡常数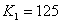 ,平衡时
,平衡时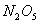 的转化率为50%
的转化率为50%
C. 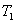 温度下的平衡常数为
温度下的平衡常数为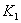 ,
,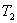 温度下的平衡常数为
温度下的平衡常数为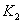 ,若
,若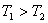 ,则
,则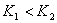
D. 达平衡后其他条件不变,将容器的体积压缩到原来的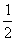 ,则再次平衡时
,则再次平衡时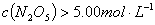
科目:高中化学 来源: 题型:
下列说法正确的是
A. 相同温度下,1 mol·L-1氨水溶液与0.5 mol·L-1氨水溶液中,c(OH-)之比是2:1
B. 0.1 mol·L-1 NH4Cl溶液中的c(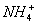 )=c(
)=c( )
)
C. 向0.1 mol·L-1NaNO3 溶液中滴加稀盐酸,使溶液pH=1,此时混合液中c(Na+)=c( )
)
D. 向醋酸钠溶液中加入适量醋酸,使 混合液的pH=7,此时混合液中c(Na+)=c(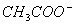 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
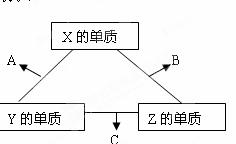 X、Y、Z三种短周期元素,它们的原子序数之和为16 。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16 。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:
已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。请回答下列问题:
(1)X元素在周期表中的位置________ _。
(2)X的单质与Z的单质可制成新型的化学电(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入__________(填物质名称);负极电极反应式为___________________ _。
(3)C在一定条件下反应生成A的化学方程式是_______________________________。
(4)已知Y的单质与Z的单质生成C的反应是可逆反应,属于放热反应。将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是____________________(填写下列各项的序号)。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为11
d.达到化学平衡的过程中,混合气体平均相对分子质量减小
e.达到化学平衡后,再升高温度,C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组为了研究电化学原理设计了如图所示的装置,下列说法中错误的是
A.X和Y不连接时,铜棒上会有金属银析出
B.X和Y用导线连接时,银棒是正极,发生氧化反应
C.若X接直流电源的正极,Y接负极,Ag+向铜电极移动
D.无论X和Y是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色

查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质分类的说法正确的是( )
A. 化合反应均为氧化还原反应
B. 液氨、液氯、液体氯化氢都是非电解质
C. 多糖、油脂、蛋白质都是高分子化合物
D. 古代的陶瓷、砖瓦,现代的玻璃、水泥等,都是硅酸盐产品
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.反应热就是反应中放出的能量
B.在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
C.由C(s,石墨)= C(s,金刚石),ΔH=1.9 kJ·mol-1可知,金刚石比石墨稳定
D.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
最近科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,另一边附着二氧化锰。电池总反应为Zn+2MnO2+H2O===ZnO+2MnOOH。下列说法不正确的是( )
A.该电池Zn为负极,MnO2为正极
B.该电池的正极反应为MnO2+e-+H2O===MnOOH+OH-
C.导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn
D.电池工作时水分子和OH-都能通过薄层纸片
查看答案和解析>>
科目:高中化学 来源: 题型:
有甲乙两个容积均为1L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g) xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:
xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:
⑴ 甲平衡时A的体积分数为 ;
⑵ 若乙W%=40%,且建立平衡的过程中乙压强有变化 ,则x= ,乙中建立平衡时压强的变化为 (填“递增”或“递减”);
⑶ 若乙W%=40%,且平衡时甲、乙压强不同,则x= ,平衡时甲的压强 乙的压强(填“大于”或“小于”),乙平衡时c(A)= ;
⑷ 若x=4,则W% 40%(填“大于”、“小于”或“等于”,下同);平衡时乙中的
c(A) 甲中的c(A)。
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O=2Fe(OH)2;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③2Fe(OH)3=Fe2O3+3H2O。
下列说法正确的是
A.反应①、②中电子转移数目相等
B.反应①中氧化剂是氧气和水
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com