
【题目】工业上常用水钴矿(主要成分为Co2O3,还含少量Fe2O3、 Al2O3、MgO、CaO等杂质) 制备钴的氧化物,其制备工艺流程如下:
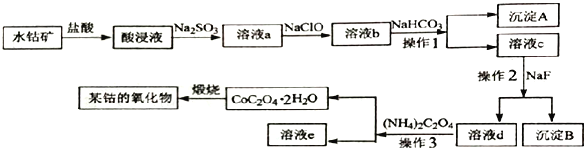
回答下列问题:
(1)在加入盐酸进行“酸浸”时,能提高“酸浸”速率的方法有______________(任写一种)。
(2)“酸浸”后加入Na2SO3,钴的存在形式为Co2+,写出产生Co2+反应的离子方程式_______________________________。
(3)溶液a中加入NaClO的作用为_______________________________。
(4)沉淀A 的成分为__________________。操作2的名称是___________________。
(5)已知: Ksp (CaF2)=5.3×10-9,Ksp(MgF2)=5.2×10-12,若向溶液c 中加入NaF溶液,当Mg2+恰好沉淀完全即溶液中c(Mg2+)=1.0×10-5moI/L,此时溶液中c(Ca2+)最大等于_________mol·L-1。
(6)在空气中煅烧CoC2O4 生成钴的某种氧化物和CO2,测得充分煅烧后固体质量为12.05 g,CO2的体积为6.72 L(标准状况),则此反应的化学方程式为_______________________________。
【答案】 将水钴矿石粉碎;充分搅拌;适当增加盐酸浓度;提高酸浸温度等 2Co3++SO32-+H2O=2Co2++SO42-+2H+ 将溶液中Fe2+氧化成Fe3+ Fe(OH)3 Al(OH)3 过滤 0.01(0.0102) 3CoC2O4+2O2 ![]() Co3O4+6CO2
Co3O4+6CO2
【解析】试题分析:本题以水钴矿为原料制备钴的氧化物的流程为载体,考查流程的分析,提高反应速率的措施,方程式的书写,溶度积的计算,化学计算。
(1)“酸浸”时为固体与液体的反应,根据外界条件对化学反应速率的影响,在加入盐酸进行“酸浸”时,能够提高“酸浸”速率的方法有:将水钴矿石粉碎,增大接触面积;充分搅拌;适当增加盐酸的浓度;适当提高酸浸的温度等。
(2)酸浸时水钴矿中的Co2O3、Fe2O3、Al2O3、MgO、CaO溶解转化为CoCl3、FeCl3、AlCl3、MgCl2、CaCl2;加入Na2SO3,钴的存在形式为Co2+,Co3+被还原为Co2+,则SO32-被氧化成SO42-,产生Co2+的反应可表示为:SO32-+Co3+→Co2++SO42-,根据得失电子守恒配平为:SO32-+2Co3+→2Co2++SO42-,根据溶液呈酸性和电荷守恒,生成Co2+的离子方程式为SO32-+2Co3++H2O=2Co2++SO42-+2H+。
(3)加入Na2SO3还会将Fe3+还原为Fe2+,反应的离子方程式为SO32-+2Fe3++H2O=2Fe2++SO42-+2H+;溶液a中含有Co2+、Fe2+、Al3+、Mg2+、Ca2+、Na+、Cl-、SO42-等,向溶液a中加入NaClO,NaClO具有强氧化性,将Fe2+氧化成Fe3+,反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O。
(4)加入NaClO溶液后得到的溶液b中含有Co2+、Fe3+、Al3+、Mg2+、Ca2+、Na+、Cl-、SO42-等;向溶液b中加入NaHCO3调节溶液的pH,使Fe3+、Al3+转化为氢氧化物沉淀而除去,沉淀A的成分为Fe(OH)3、Al(OH)3;溶液c中含有Co2+、Mg2+、Ca2+、Na+、Cl-、SO42-等,向溶液c中加入NaF,Mg2+、Ca2+转化为难溶于水的MgF2、CaF2沉淀,操作2的名称为过滤。
(5)当Mg2+恰好沉淀完全,Ksp(MgF2)=c(Mg2+)·c2(F-)=5.2![]() 10-12,c(Mg2+)=1.0
10-12,c(Mg2+)=1.0![]() 10-5mol/L,则c2(F-)=5.2
10-5mol/L,则c2(F-)=5.2![]() 10-7;Ksp(CaF2)=c(Ca2+)·c2(F-)=5.3
10-7;Ksp(CaF2)=c(Ca2+)·c2(F-)=5.3![]() 109,c(Ca2+)=5.3
109,c(Ca2+)=5.3![]() 10-9
10-9![]() (5.2
(5.2![]() 10-7)=0.0102(mol/L),此时溶液中c(Ca2+)最大等于0.0102mol/L。
10-7)=0.0102(mol/L),此时溶液中c(Ca2+)最大等于0.0102mol/L。
(6)n(CO2)=![]() =0.3mol,根据C守恒,n(CoC2O4)=0.15mol,根据Co守恒,n(Co)=0.15mol,所得钴的氧化物中n(O)=
=0.3mol,根据C守恒,n(CoC2O4)=0.15mol,根据Co守恒,n(Co)=0.15mol,所得钴的氧化物中n(O)=![]() =0.2mol,n(Co):n(O)=0.15mol:0.2mol=3:4,生成的钴的氧化物的化学式为Co3O4,在空气中煅烧CoC2O4的化学方程式为3CoC2O4+2O2
=0.2mol,n(Co):n(O)=0.15mol:0.2mol=3:4,生成的钴的氧化物的化学式为Co3O4,在空气中煅烧CoC2O4的化学方程式为3CoC2O4+2O2![]() Co3O4+6CO2。
Co3O4+6CO2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知: ![]() 溶液是检验
溶液是检验![]() 的试剂,若溶液中存在
的试剂,若溶液中存在![]() ,将产生蓝色沉淀。将
,将产生蓝色沉淀。将![]() 的KI溶液和
的KI溶液和![]()
![]() 溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“
溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“![]() ”的是
”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入 | 有黄色沉淀生成 |
③ | 滴入 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ① B. ②和④ C. ③和④ D. ①和②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图所示实验测量m g铜银合金样品中铜的质量分数:
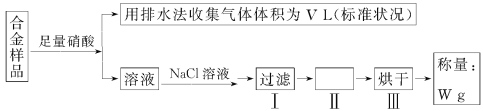
下列说法中不正确的是 ( )
A. 收集到的V L气体全为NO
B. 过滤用到的玻璃仪器:烧杯、漏斗、玻璃棒
C. 操作Ⅱ应是洗涤
D. 铜的质量分数为![]() ×100%
×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是
CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是
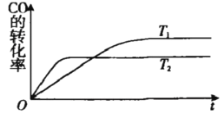
A.T1>T2,该反应的△H>0
B.加入催化剂可以提高CO的转化率
C.T1时的平衡常数时的平衡常数K1>T2时的平衡常数K2
D.温度降低,CO(g)+2H2(g)![]() CH3OH(I)的△H值将变大
CH3OH(I)的△H值将变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.天然油脂的分子中含有酯基,属于酯类
B.煤经处理变为气体燃料的过程属于物理变化
C. A12O3可以与水反应得到其对应水化物 Al(OH)3
D.可以用加热使蛋白质变性的方法分离提纯蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍铬钢俗称不锈钢,在日常生活中应用广泛,含有铁、铬、镍、碳等元素。
请回答下列问题:
(1)镍的基态原子核外价层电子排布式为_______________,基态Fe3+有_____种不同运动状态的电子,基态铬原子有__________个未成对电子。
(2)配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是_______________(填元素符号),铬的高价化合物可将CH3CH2OH 氧化为CH3CHO,CH3CHO 中—CH3和—CHO 中碳原子的杂化方式分别为_______________、___________________。
(3)镍能与CO 形成Ni(CO)4,常温下Ni(CO)4是无色液体,易溶于有机溶剂,推测Ni(CO)4是__________晶体,组成Ni(CO)4的三种元素电负性由大到小的顺序为_______________(填元素符号),CO 分子中π键与σ键的个数比为_______________。
(4)NiO 的立方晶体结构如图所示,则O2-填入Ni2+构成的________空隙(填“正四面体”、“正八面体”、“ 立方体”或“压扁八面体”)。NiO晶体的密度为ρg·cm-3,Ni2+和O2-的半径分别为r1pm和r2pm,阿伏加德罗常数值为NA,则该晶胞中原子的体积占晶胞体积的百分率为___________________________________。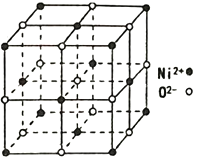
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁和无水氯化镁具有广泛的用途。用白云石(CaCO3·MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如下:
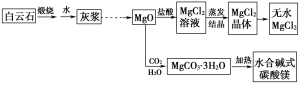
回答下列问题:
(1)“灰浆”中除水和MgO外,主要成分还有________________________。
(2)为探究所得的水合碱式碳酸镁[mMgCO3·nMg(OH)2·xH2O]的组成,某同学组装仪器如图所示:
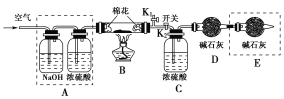
实验测得:硬质玻璃管中剩余的固体质量为1.60 g,C处浓H2SO4增重0.72 g,D处碱石灰(主要成分为氧化钙和氢氧化钠)增重1.32 g,此水合碱式碳酸镁的化学式为________。
(3)A框中装置的作用是___________________________________________;在装好试剂后,加热前应进行的操作是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com