
 ;
;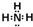 ;
;分析 A、B、C三种元素的原子具有相同的电子层数,1molA的单质能跟足量的盐酸反应,在标准状况下可置换出22.4L的H2,A为金属,令A反应后化合价为x,则根据电子转移守恒,1x=2,所以x=2,即A反应后为+2价,这时A转变为与氖原子具有相同电子层结构的离子,则A为镁元素.而B的核电荷数比A大1,则B为铝元素;C原子的电子总数比B原子的电子总数多4,则C为氯元素,结合元素单质、化合物的性质解答该题.
解答 解:A、B、C三种元素的原子具有相同的电子层数,1molA的单质能跟足量的盐酸反应,在标准状况下可置换出22.4L的H2,A为金属,令A反应后化合价为x,则根据电子转移守恒,1x=2,所以x=2,即A反应后为+2价,这时A转变为与氖原子具有相同电子层结构的离子,则A为镁元素.而B的核电荷数比A大1,则B为铝元素;C原子的电子总数比B原子的电子总数多4,则C为氯元素.
(1)用电子式表示氯化镁的形成过程为 ,故答案为:
,故答案为: ;
;
(2)B的离子是铝离子,电子式为Al3+;与铝离子具有相同电子数的分子中,有一种分子可与盐酸化合生成一种盐,该分子是氨分子,电子式是 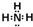 ,故答案为:Al3+;
,故答案为:Al3+;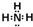 ;
;
(3)B最高价氧化物的水化物为氢氧化铝,C最高价氧化物的水化物为高氯酸,二者反应的离子方程式:Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O.
点评 考查结构性质与位置关系、电子式与离子方程式等化学用语、化学计算等、离子方程式等,难度不大,根据计算推断A元素是解题关键,是对所学知识的综合考查.


科目:高中化学 来源: 题型:选择题
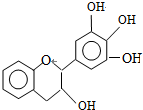
| A. | 分子式为C15H12O5 | |
| B. | 1molEGC与5molNaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,不能发生消去反应 | |
| D. | 遇FeCl3溶液能发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电负性 离子半径 键的极性 | 熔点 |
| N<O O2->Al3+ C-H<H-O | Al<Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
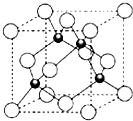 X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.
X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.| r(Zn2+) | r(Z+) | r(S2-) | r(Cl-) | 熔点 | |
| ZnS | ZCl | ||||
| 74pm | 77pm | 184pm | 181pm | 1700℃ | 430℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠与浓硫酸混合加热后,撒入二氧化锰即放出氯气 | |
| B. | 过氧化氢中加入几滴氯化铁溶液,可较快放出气体 | |
| C. | 在木炭粉中加入微量氯酸钾,燃烧时极为剧烈 | |
| D. | 用锌与稀硫酸反应制备氢气时,加入少量硫酸铜加快反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
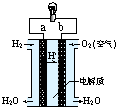
| A. | 电子由b通过灯泡流向a | |
| B. | 氢氧燃料电池是环保电池 | |
| C. | a极是负极 | |
| D. | 正极的电极反应是:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和苯酚均无毒,但都能用于消毒、杀菌 | |
| B. | 乙醇和苯酚均能和金属Na反应置换出氢气 | |
| C. | 苯酚能与甲醛反应制造酚醛树脂 | |
| D. | 乙醇的沸点比乙烷高是因为乙醇分子间可以形成氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
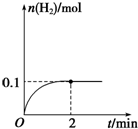 一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.
一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X中含有碳碳双键 | B. | X中含有一个羧基和两个羟基 | ||
| C. | X中含有两个羧基和一个羟基 | D. | X中含有三个羟基和一个-COOR |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com