
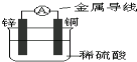
| A、当有0.2mol电子通过电路,产生H2体积为2.24L |
| B、电子从锌片经金属导线流向铜片 |
| C、铜片质量逐渐减少 |
| D、溶液中的氢离子向锌电极移动 |


科目:高中化学 来源: 题型:
| A、加入10mL 3mol?L-1盐酸 |
| B、给反应混合物加热 |
| C、将所用的大理石研磨成粉末 |
| D、加入10mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
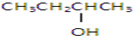
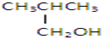
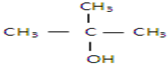
| A、①② | B、只有② |
| C、②和③ | D、③和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12g碳所含的原子数就是阿伏加德罗常数 |
| B、阿伏加德罗常数没有单位 |
| C、“物质的量”指物质的质量 |
| D、摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
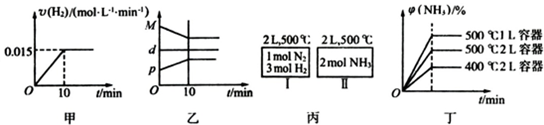 ( )
( )| A、若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示 |
| B、反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙 |
| C、如图丙所示,容器I和II达到平衡时所需要的时间可能不同 |
| D、若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:
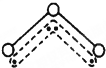 臭氧分子的结构如图,呈V型,三个原子以一个O原子为中心,与另外两个O原子分别构成共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键:三个O原子均等地享用这4个电子.则下列微粒中与O3的结构最相似的是( )
臭氧分子的结构如图,呈V型,三个原子以一个O原子为中心,与另外两个O原子分别构成共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键:三个O原子均等地享用这4个电子.则下列微粒中与O3的结构最相似的是( )| A、SO2 |
| B、C3H6 |
| C、CO2 |
| D、CNO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该条件下,气体的摩尔体积是22.4L?mol-1 |
| B、该条件下,32gO2的体积是22.4L |
| C、该条件下,1molN2的体积是11.2L |
| D、该条件下,9.03×1023个H2O分子的体积是16.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2HCl+Na2CO3=H2O+CO2↑+2NaCl |
| B、NaHCO3+HCl=NaCl+CO2↑+H2O |
| C、H2SO4+K2CO3=H2O+CO2↑+2KCl |
| D、2HNO3+K2CO3=H2O+CO2↑+2KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在任何化学反应中,只要提高反应温度,就可提高反应速率 |
| B、在任何化学反应中,只要增大某一反应物的用量,就会增大反应速率 |
| C、在任何化学反应中,增大压强时,都会使反应速率增大 |
| D、在任何化学反应中,只要缩小容器的体积,都会使反应速率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com