
| 0.018 |
| 2 |
| 0.02 |
| 2 |
| 1.8×10-10 |
| 0.001 |
| 1.8×10-7 |
| 0.15 |


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| B、物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
| C、除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大 |
| D、沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-23 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大反应物浓度,可逆反应正速率增大;减少反应物浓度,可逆反应逆速率增大 |
| B、粗铜精炼时,电解质液中的c(Cu2+)保持不变 |
| C、纯银在空气中久置变黑发生的是电化学腐蚀 |
| D、阴极电保护法是将被保护的金属与外加电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:
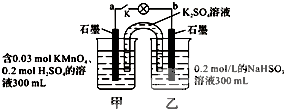
| A、当电路中有1.204×1022个电子转移时,乙烧杯中溶液的C(H+)约为0.1mol?L-1 |
| B、电池工作时,盐桥中的K+移向甲烧杯 |
| C、电池工作时,外电路的电子方向是从a到b |
| D、乙池中的氧化产物为SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、此时,反应混合物总的物质的量为1mol |
| B、B的转化率为50% |
| C、A的平均反应速率为0.1mol?(L?min)-1 |
| D、a值为2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏 | B、分液 | C、过滤 | D、蒸发 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com