
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
(1)写出反应的离子方程式___________________________
(2)下列三种情况下,离子方程式与(1)相同的是________(填序号).
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO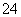 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
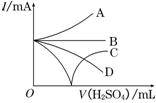
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用右图中的曲线表示是________(填序号).
(4)若向装有Ba(OH)2溶液烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应.则反应的离子方程式是 _________________________________.
【知识点】离子方程式、元素化合物B1C5
【答案解析】(1)Ba2++2OH-+2H++SO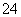 ===BaSO4↓+2H2O (2)A (3)C
===BaSO4↓+2H2O (2)A (3)C
(4) 2Ba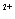 +4OH
+4OH +Al
+Al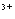 +2SO
+2SO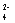 =2BaSO
=2BaSO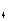 ↓ + AlO
↓ + AlO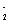 +2H
+2H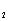 O
O
解析:⑴Ba(OH)2溶液中逐滴加入稀硫酸生成水和硫酸钡沉淀,离子反应为Ba2++2OH-+2H++SO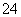 ===BaSO4↓+2H2O
===BaSO4↓+2H2O
⑵A的离子反应分别是Ba2++2OH-+2H++SO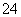 ===BaSO4↓+2H2O,B、C的离子反应是Ba2++OH-+H++SO
===BaSO4↓+2H2O,B、C的离子反应是Ba2++OH-+H++SO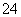 ===BaSO4↓+H2O,选A。
===BaSO4↓+H2O,选A。
⑶随着H2SO4的加入至二者刚好反应时,溶液的导电能力逐渐减弱至不导电,随后硫酸过量,溶液的导电能力逐渐增强,选C。
⑷若向装有Ba(OH)2溶液烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应,此时二者物质的量比为2:1,则OH-与Al3+的物质的量比为4:1,Al3+全部变为AlO2-,即
2Ba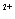 +4OH
+4OH +Al
+Al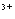 +2SO
+2SO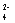 =2BaSO
=2BaSO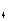 ↓ + AlO
↓ + AlO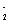 +2H
+2H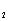 O。
O。
【思路点拨】本题⑷的离子方程式的书写可采取目标法:1molBa2+恰好完全反应,则需KAl(SO4)20.5mol,而OH-与Al3+的物质的量比则为4:1,Al3+全部变为AlO2-。


科目:高中化学 来源: 题型:
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确的是( )
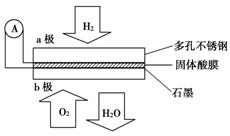
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-===4OH-
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
.有一种白色粉末由等质量的两种物质混合而成,分别取适量该白色粉末置于三支试管中进行实验。(1)逐滴加入6mol·L-1盐酸,同时不断振荡试管,有气泡产生,反应结束后得到无色透明溶液(2)加热试管中的白色粉末,试管口有水滴凝结(3)逐滴加入6mol·L-1硫酸,同时不断振荡试管,有气泡产生,反应结束后试管中还有白色不溶物。下列混合物中符合以上实验现象的是( )
A.NaHCO3、AgNO3 B.BaCl2、MgCO3 C.NH4HCO3、MgCl2 D.CaCl2·6H2O、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
(一)(6分)中学常见单质A、B和甲、乙、丙三种化合物有如图所示的转换关系(部分产物未列出)。单质A常作为食品包装材料,甲是两性氧化物。
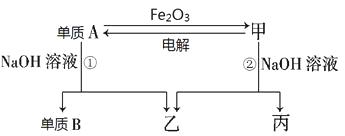
根据图示转化关系回答:
(1)写出下列物质的化学式:单质A_______________,乙_______________。
(2)写出单质A与Fe2O3反应的化学方程式: ,
利用该反应的原理,可用于______________________________。
(3)用单质A做成的容器可以储存和运输浓硫酸的原因是_________________。
(4)写出反应①的离子方程式:_________________________________。
(二)(4分)(5)工业上冶炼下列物质通常不采用电解法的是 。
a.Na b.Mg c.Fe d.Ag
(6)、用铝粉和Fe2O3做铝热反应实验,需要的试剂还有( )
a.KCl b. KClO 3 c. MnO2 d. Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
美国科学家将铅和氪两种元素的原子核对撞,获得了一种质子数为118、质量数为293的新元素,该元素原子核内的中子数和核外电子数之差为 ( )
A.47 B.175 C.61 D.57
查看答案和解析>>
科目:高中化学 来源: 题型:
冶炼金属一般有下列四种方法: ① 焦炭法;② 水煤气(或H2、CO)法;③ 活泼金属置换法;④ 电解法。这四种方法在工业上均有应用。古代有: (Ⅰ) 火烧孔雀石炼铜;(Ⅱ) 湿法炼铜。现代有: (Ⅲ) 铝热法炼铬;(Ⅳ) 从光卤石中炼镁。对它们的冶炼方法的分析中不正确的是(B)
A. (Ⅰ), ①
B. (Ⅱ),②
C. (Ⅲ),③
D. (Ⅳ),④
查看答案和解析>>
科目:高中化学 来源: 题型:
羧酸酯RCOOR′在催化剂存在时可与醇R″OH发生如下反应(R′、R″是两种不同的烃基):
RCOOR′+R″—OH RCOOR″+R′—OH
RCOOR″+R′—OH
此反应称为酯交换反应,常用于有机合成。广泛用于婴儿“尿不湿”等吸水产品的聚乙烯醇就是利用这一原理生产的:用聚乙酸乙烯酯与过量甲醇在一定条件下反应,可得聚乙烯醇和乙醇甲酯。
(1)反应中甲醇为什么要过量?
________________________________________________________________________
________________________________________________________________________。
(2)写出聚乙酸乙烯酯与甲醇进行酯交换反应的化学方程式:
_______________________________________________________________________
________________________________________________________________________。
(3)酯交换反应也可用于从废弃的涤纶树脂(聚对苯二甲酸乙二醇酯,结构简式为
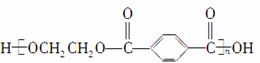 )中回收其单体以用于树脂的再合成。写出用过量的甲醇处理废弃涤纶树脂过程中反应的化学方程式。
)中回收其单体以用于树脂的再合成。写出用过量的甲醇处理废弃涤纶树脂过程中反应的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学卷·2015届浙江省嘉兴市高三上学期学科基础测试(201409)】30.(本题10分)实验室从含碘废液(除H2O外,含有CCl4, I2, I-等)中回收碘,其实验过程如下:

(1)操作x的名称为________________。主要的仪器是_______________________。
(2)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的 I2 还原为I-,其离子方程式为_________;该操作的目的是____________________。
(3)①在测定亚硫酸钠溶液浓度时,量取25.00mL亚硫酸钠溶液,用0.10mol·L-1的酸性高锰酸钾溶液进行滴定,下列说法正确的是_________________。
A.润洗滴定管时,应从滴定管上口加满所需的试液,使滴定管内壁充分润洗
B.高锰酸钾溶液装在酸式滴定管中,本实验无需外加指示剂
C.滴定时,眼睛注视滴定管中液面的变化
D.滴定开始时读数正确,滴定终点仰视读数,会使实验误差偏高
②达到滴定终点时,消耗高锰酸钾溶液18.00mL,则亚硫酸钠溶液的浓度为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com