
分析 (1)根据n=$\frac{m}{M}$$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$结合物质的构成解答该题;
(2)含元素化合价变化的反应为氧化还原反应,水被氧化,则水中O元素的化合价升高,水被还原,则水中H元素的化合价降低;若水中H、O元素的化合价不变,则H2O既不被氧化,又不被还原,以此解答该题;
(3)根据物质导电的原因分析,只要含有自由移动的离子或自由电子即可;在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水,只有熔融态的电解质才能导电.
解答 解:(1)①n(CO2)=$\frac{22g}{44g/mol}$=0.5mol,②n(H2)=$\frac{5g}{2g/mol}$=2.5mol,③n(N2)=$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}mo{l}^{-1}}$=2mol,④n(H2O)=$\frac{18g}{18g/mol}$=1mol,
则由n=$\frac{N}{{N}_{A}}$可知,物质的量越多,则分子数越多,所以所含分子数最多的是②;
质量分别为①22g,②5g,③2mol×28g/mol=56g,④18g,则质量最大的是③;
由n=$\frac{V}{{V}_{m}}$可知,气体的物质的量越多,体积越大,则体积最大的是②,
故答案为:②;③;②;
(2)只有①⑤反应中没有元素的化合价变化,不属于氧化还原反应;
只有③水中O元素的化合价升高,水被氧化;
只有④水中H元素的化合价降低,水被还原化;
只有②中属于氧化还原反应,但水中H、O元素的化合价不变,则H2O既不被氧化,又不被还原,
故答案为:①⑤;③;④;②;
(3))②熔融的NaCl中有自由移动的离子,所以能导电;③盐酸中含有自由移动的氢离子和氯离子,能够导电;④铜丝中有自由电子,所以能导电;
⑤NaOH固体、⑥SO2、⑦CuSO4固体⑧K2O固体、⑨液态H2SO4中没有自由移动的离子或自由电子,所以不能导电,但在水溶液中能够导电,属于电解质,
故答案为:②③④;⑤⑦⑧⑨.
点评 本题考查较为综合,涉及物质的量的计算、电解质与非电解质、氧化还原反应等知识,明确氧化还原反应的实质、电解质与非电解质的概念为解答关键,注意掌握物质的量与其它物理量之间的关系,试题培养了学生的灵活应用能力.


科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是( )
A.加入一种反应物 B.升高温度
C.对平衡体系增加压强 D.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同物质的量的浓度的三种溶液:Na2SO4、MgSO4、Al2(SO4)3,其体积比为3:2:1,则SO42-浓度之比为1:1:3 | |
| B. | 将10 mL 1 mol/L H2SO4稀释成0.1 mol/L的H2SO4,可向该溶液中加入100 mL水 | |
| C. | 将1 mol/L的NaCl溶液和0.5 mol/L的BaCl2溶液等体积混合后,不考虑溶液体积变化c(Cl-)=0.75 mol/L | |
| D. | 50 g浓度为c mol/L,密度为ρ g•cm-3的氨水(ρ<1)中加入一定量的水(ρ=1g•cm-3)稀释成0.5c mol/L,则加入水的体积应小于50 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
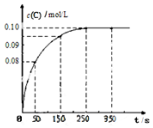 在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )
在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )| A. | 反应在 0~50 s 的平均速率=1.6×10-3mo1/(L•s) | |
| B. | 该温度下,反应的平衡常数值为0.025 | |
| C. | 反应平衡后,再向容器中充入A、B、C各1mol,此时v(正)<v(逆) | |
| D. | 保持其他条件不变,升高温度,平衡时c(B)=0.11mol/L,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平均相对分子质量 | B. | SO3(g)的转化率 | ||
| C. | $\frac{c(S{O}_{3})}{c(S{O}_{2})}$ | D. | c2(SO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com