
【题目】一定温度下,在容积为VL的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
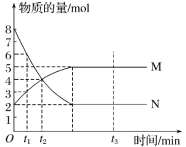
(1)此反应的化学方程式中![]() =____。
=____。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为_____。
(3)下列叙述能说明上述反应达到平衡状态的是____(填字母)。
A 反应中M与N的物质的量之比为1∶1
B 混合气体的总质量不随时间的变化而变化
C 混合气体的总物质的量不随时间的变化而变化
D 单位时间内消耗a mol N,同时生成b mol M
E 混合气体的压强不随时间的变化而变化
【答案】2 (t2-t1)×Vmol·L-1·min-1 CE
【解析】
(1)参加反应的N的物质的量为8mol-2mol=6mol,生成的M的物质的量是5mol-2mol=3mol,所以此反应的化学方程式中a:b=2:1,故答案为:2:1;
(2)由图可知,t1到t2时刻M的物质的量变化为4mol-3mol=1mol,v=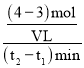 ═
═![]() molL-1min-1;
molL-1min-1;
(3)A.平衡时反应混合物各组分的物质的量不变,但各组分的物质的量不一定相等,选项A错误;
B.混合气体的总质量始终不变,混合气体总质量不变不能说明到达平衡,选项B错误;
C.由于a≠b,随反应进行混合气体总物质的量发生变化,混合气体的总物质的量不随时间的变化而变化,说明到达平衡,选项C正确;
D.单位时间内消耗amolN,同时生成bmolM,都表示正反应速率,反应始终按此关系进行,不能说明到达平衡,选项D错误;
E.由于a≠b,随反应进行混合气体总物质的量发生变化,混合气体的压强不随时间的变化而变化,说明混合气体总的物质的量再不变,说明反应到达平衡,选项E正确;
答案选CE。


科目:高中化学 来源: 题型:
【题目】常温下,物质的量浓度均为0.1mol·L-1的下列溶液:①CH3COONa ②NaOH ③NaHSO4
④NH4Cl ⑤ NaCl,溶液的pH由大到小的顺序排列正确的是
A. ②>⑤>①>③>④ B. ②>①>⑤>③>④
C. ②>①>⑤>④>③ D. ②>⑤>③>④>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“结晶玫瑰”具有强烈的玫瑰香气,是一种很好的定香剂,其化学名称为“乙酸三氯甲基苯甲酯”,通常以三氯甲基苯基甲醇和醋酸酐为原料制备:
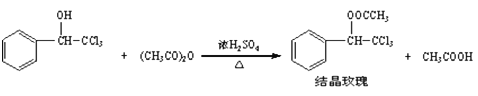
已知:

操作步骤如下:
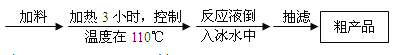
请根据以上信息,回答下列问题:
(1)加料时,应先加入三氯甲基苯基甲醇和酷酸酐,然后慢慢加入浓硫酸并______,待混合均匀后,最适宜的加热方式为______(填“水浴加热”或“油浴加热”)。
(2)粗产品的成分是结晶攻瑰与少量_______(填名称)的混合物,设计了如下方案进行提纯和检验。请完成表中内容:
序号 | 实验方案 | 实验现象 | 结论 |
① | 将粗产品溶解在中,按粗产品、溶剂的质量比为1:__混合,用水浴加热到70℃回流溶剂使粗产品充分溶解 | 得到无色溶液 | |
② | 将步骤1所得溶液____________抽滤 | 得到白色晶体 | |
③ | 干燥步骤2所得白色晶体,____________ | _____________ | 白色晶体是结晶玫瑰 |
(3)4.51g三氯甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰4.68g,则产率是________(小数点后保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的说法中,不正确的是
A.与其他分散系的本质区别是能否发生丁达尔效应
B.分散质粒子直径在10-9~l0-7 m之间
C.分散质粒子能穿过滤纸
D.属于介稳体系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于下图所示电化学装置的分析正确的是

A. 若X为直流电源,Y为铜棒接正极,则Fe棒上镀铜
B. 若X为直流电源,Y为碳棒接负极,则Fe棒被保护
C. 若X为电流计,Y为锌棒,则SO42-移向Fe棒
D. 若X为导线,Y为铜棒,则Fe棒发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组测定某Fe2(SO4)3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取a g样品,置于烧杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.0 mL溶液;
③量取25.0 mL步骤②中配得的溶液,置于烧杯中,加入适量氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑥……
请根据上面叙述,回答:
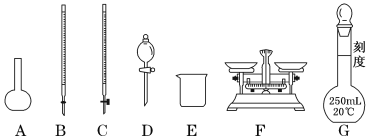
(1)上图所示仪器中,步骤①②③中必须用到的仪器有E和___________(填字母)。
(2)步骤②中:配制50 mL 1.0 mol/L稀H2SO4,需要用量筒量取98%(密度1.84 g/cm3)的浓H2SO4体积为________ mL。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
____Fe2++ ClO2+ === Fe3++ Cl-+ H2O
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果的影响是__________(填“偏大”“偏小”或“不影响”),等物质的量ClO2与Cl2的氧化效率之比为__________。
(4)若步骤⑤不在干燥器中冷却,则测定的铁元素的质量分数会________(填“偏大”“偏小”或“不影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com