
| A. | Cl2、SO2均能品红溶液褪色,说明二者漂白原理相同 | |
| B. | 浓Na2SO4溶液和甲醛都能使蛋白质从溶液中析出,说明二者均使蛋白质发生盐析 | |
| C. | CO2、SO2使澄清石灰水变浑浊,说明二者均为酸性氧化物 | |
| D. | 溶液中滴加硝酸酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
分析 A.氯气和二氧化硫具有漂白性,氯气利用的是次氯酸的强氧化性,二氧化硫利用的是结合有色物质形成不稳定的无色物质;
B.甲醛为有机物,浓硫酸具有强氧化性,都能是蛋白质变性;
C.酸性氧化物能够与碱反应生成盐和水;
D.亚硫酸根离子能被硝酸氧化生成硫酸根子;
解答 解:A.Cl2、SO2均能使品红溶液褪色,氯气和水反应生成次氯酸具有漂白性,把有色物质氧化为无色物质,二氧化硫是结合有色物质形成不稳定的无色物质,加热恢复原来的颜色,未发生氧化还原反应,二者漂白原理不同,故A错误;
B.甲醛为有机物,浓硫酸具有强氧化性,都能是蛋白质变性,故B错误;
C.CO2、SO2使澄清石灰水变浑浊,是因为反应分别生成碳酸钙和、水,亚硫酸钙和水,符合酸性氧化性概念,均为酸性氧化物,故C正确;
D.溶液中滴加硝酸酸化的Ba(NO3)2溶液出现白色沉淀,不能说明该溶液中一定有SO42-,有可能含有亚硫酸根离子,故D错误;
故选:C.
点评 本题综合考查元素化合物知识,涉及常见漂白剂及漂白原理判断,蛋白质的变性与盐析,酸性氧化物的判断,离子的检验,熟悉相关物质的性质是解题关键,题目难度中等.


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:解答题

 +CaCl2+H2O,该反应的原子利用率25.4%.
+CaCl2+H2O,该反应的原子利用率25.4%. ,
, )与乙二醇作用,可生成一系列化合物:
)与乙二醇作用,可生成一系列化合物: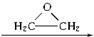 HO-CH2-CH2-O-CH2-CH2-OH
HO-CH2-CH2-O-CH2-CH2-OH
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42- | |
| B. | 加入少量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO- | |
| C. | 加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH- | |
| D. | 加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 2 | 3 | 4 | 5 |
| c(NO)/10-3 mol•L-1 | 1.00 | 0.25 | 0.16 | 0.10 | 0.10 |
| c(CO)/10-3 mo l•L-1 | 3.60 | 2.85 | 2.76 | 2.70 | 2.70 |
| A. | 0~2 s间的平均反应速率v(NO)=3.75×10-3mol/(L•s) | |
| B. | 催化转化器对废气的转化速率在冬季时比夏季时高 | |
| C. | 选用更有效的催化剂可以提高污染物的转化率 | |
| D. | 该温度下,此反应的平衡常数K=5.0×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 0.068 MPa-1 | B. | 0.082 | C. | 0.072 MPa-1 | D. | 0.082 MPa-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com