
| A、航天飞机上的隔热陶瓷瓦属于复合材料 |
| B、水泥、陶瓷均为硅酸盐产品 |
| C、“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关 |
| D、化学反应能够制造出新的物质,同时也能制造出新的元素 |


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
| A、两途径最终达到平衡时,体系内混合气体各组分百分组成相同 |
| B、两途径最终达到平衡时,体系内混合气体各组分百分组成不同 |
| C、达到平衡时,途径I的反应速率等于途径Ⅱ的反应速率 |
| D、达到平衡时,途径I所得混合气的密度等于途径Ⅱ所得混合气密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
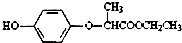 是一种合成农药所需的重要中间体.下列有关HPE的说法不正确的是( )
是一种合成农药所需的重要中间体.下列有关HPE的说法不正确的是( )| A、该有机物的分子式为C11H14O4 |
| B、该有机物具有7种不同化学环境的氢原子 |
| C、该有机物能与NaOH溶液反应,生成3种有机物 |
| D、1mol该有机物完全燃烧,将消耗12.5molO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽车尾气中含有NOx,NOx是引起温室效应的主要气体之一 |
| B、N2中π键与σ键之比为1:2 |
| C、反应③中每生成标况下的22.4 L N2转移电子数1.5NA |
| D、NH3的沸点比PH3的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、锂离子电池与传统铅蓄电池相比,具有高比能量(比能量指的是单位重量或单位体积的能量)的特点 |
| B、废旧锂离子电池先进行“放电处理”让Li+进入石墨(C6)中而利于回收 |
| C、放电时,正极锂的化合价未发生改变 |
| D、充电时电池正极上发生的反应为:LiCoO2-x e-═Li1-x CoO2+xLi+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,3.36L氯气与2.7g铝充分反应转移的电子数小于0.3NA |
| B、标准状况下,5.6L O2作氧化剂时转移电子数一定为NA |
| C、0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA |
| D、80g CuO和Cu2S的混合物含有铜原子数一定为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com