
A.1 mol·L-1,100 mL B.0.5 mol·L-1,80 mL
C.1 mol·L-1,60 mL D.1 mol·L-1,80 mL
科目:高中化学 来源: 题型:
(1)下列实验设计或操作均有不妥之处,其中存在安全隐患或可能产生安全事故的是_______。
①直接点燃未检验纯度的CO
②石油分馏实验时,不加沸石直接加热蒸馏
③用混有炭粉的二氧化锰与氯酸钾混合加热制氧气
④在稀释浓硫酸时,将水直接倒入浓硫酸中
⑤制Cl2用1 mol·L-1盐酸与MnO2作用
(2)已知KMnO4(158.0 g·mol-1)可将草酸根离子完全氧化成二氧化碳,因此草酸根离子常被用以测定高锰酸钾溶液的浓度:

![]() +
+![]() +16H+
+16H+![]() 2Mn2++10CO2↑+8H2O,现称取0.670 0 g的草酸钠(134.0 g·mol-1)溶于约30 mL水中,加入10 mL稀硫酸(3 mol·L-1)后趁热以高锰酸钾溶液滴定。试完成下列问题:
2Mn2++10CO2↑+8H2O,现称取0.670 0 g的草酸钠(134.0 g·mol-1)溶于约30 mL水中,加入10 mL稀硫酸(3 mol·L-1)后趁热以高锰酸钾溶液滴定。试完成下列问题:
①滴定时KMnO4溶液应盛放在_________滴定管中,测定后的溶液应保存在_________试剂瓶中(填:“棕色”或“无色”)。
②如何判断恰好完全反应____________________。
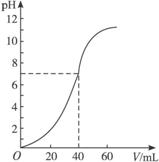
③开始时滴定管液面恰好处于“0”刻度处(此滴定管最小刻度为0.1 mL),到滴定终点时,处于图示位置,体积读数为: _________mL;根据以上数据计算出KMnO4溶液物质的量浓度为_________。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省杭州地区七校高二上学期期中考试化学试卷(解析版) 题型:填空题
硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4-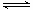 H++SO42-.
H++SO42-.
请据此回答下列有关问题:
(1)Na2SO4溶液呈 (填“弱酸性”、“中性”或“弱碱性”),原因是: (用离子方程式表示)
(2)写出H2SO4溶液与BaCl2溶液反应的离子方程式: ;
(3)在0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是 。(填编号)
A.c(SO42-)+c(HSO4-)=0.1 mol·L-1 B.c(SO42-)+c(HSO4-)=2 c(Na+)
C.c(OH-)=c(H+)+c(HSO4-) D.c(Na+)+c(H+)=c(OH-)+c(HSO4-)
(4)已知0.1 mol·L-1的NaHSO4溶液的pH=2,则0.1 mol·L-1的H2SO4溶液中SO42-的浓度 0.01mol·L-1(填“>” “=” 或“<”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年重庆市高三上学期12月月考理综化学试卷(解析版) 题型:填空题
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1 mol·L﹣1 100 mL NaOH溶液恰好完全吸收0.1 mol SO2气体,此反应的离子方程式为 ;该溶液pH_______7(填“=”“>”或“<”)。
(2)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。

实验①可说明________(填字母)
A.该Na2S2O3溶液中水电离的c(OH﹣)=10﹣8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32﹣+2H2O=H2S2O3+2OH﹣
写出实验②发生反应的离子方程式 。
(3)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O(摩尔质量为248g/mol)的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32﹣全部被氧化时,消耗KMnO4溶液体积20.00 mL。(已知:5S2O32﹣+8MnO4﹣+14H+=8Mn2++10SO42﹣+7H2O)。
试回答:
①KMnO4溶液置于——(填“酸式”或“碱式”)滴定管中,滴定终点的现象为 。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果_____________(填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:新疆自治区月考题 题型:填空题
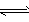 H++B2-
H++B2- 查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:
H2SO4=H++HSO4-,HSO4-![]() H++SO42-.
H++SO42-.
请据此回答下列有关问题:
(1)Na2SO4溶液呈 (填“弱酸性”、“中性”或“弱碱性”),原因是: (用离子方程式表示)
(2)写出H2SO4溶液与BaCl2溶液反应的离子方程式: ;
(3) 在0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是 。(填编号)
A.c(SO42-)+c(HSO4-)=0.1 mol·L-1 B.c(SO42-)+c(HSO4-)=2 c(Na+)
C.c(OH-)=c(H+)+c(HSO4-) D.c(Na+)+c(H+)=c(OH-)+c(HSO4-)
(4)已知0.1 mol·L-1的NaHSO4溶液的pH=2,则0.1 mol·L-1的H2SO4溶液中SO42-的浓度 0.01mol·L-1(填“>” “=” 或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com