
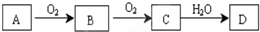
分析 题中能发生连续氧化的非金属单质A,对应的D为强酸,则对应的反应有硫和氮元素及其化合物的转化:
(1)A在常温下为淡黄色固体,是非金属单质判断A为S,B是有刺激性气味的无色气体转化关系可知为二氧化硫,则A为S元素,B为SO2,C为SO3,D为H2SO4,
①氯气具有强氧化性,二氧化硫具有还原性,在水溶液中发生氧化还原反应生成硫酸和盐酸;
②D为H2SO4,D的浓溶液与铜反应生成硫酸铜、二氧化硫和水;
(2)A在空气中的主要成分,C是红棕色的气体,则A应为N2,B为NO,C为NO2,D为HNO3,
①A应为N2,B为NO,A可与O2反应生成NO;
②D为HNO3,稀溶液具有强氧化性,可与Cu发生氧化还原反应生成硝酸铜和NO;
结合物质的性质解答该题.
解答 解:题中能发生连续氧化,对应的反应有硫和氮元素及其化合物的转化:
(1)A在常温下为淡黄色固体,是非金属单质判断A为S,B是有刺激性气味的无色气体转化关系可知为二氧化硫,则A为S元素,B为SO2,C为SO3,D为H2SO4,
①氯水和B为SO2皆可作漂白剂,若同时使用于漂白一种物质时,因为氯气具有强氧化性,二氧化硫具有还原性,在水溶液中发生氧化还原反应生成硫酸和盐酸,漂白效果减弱,反应的化学方程式为:SO2+Cl2+2H2O=2HCl+H2SO4,
故答案为:减弱; SO2+Cl2+2H2O=2HCl+H2SO4;
②D为H2SO4,D的浓溶液与铜反应的化学反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)A在空气中的主要成分,C是红棕色的气体,则A应为N2,B为NO,C为NO2,D为HNO3,
①A应为N2,B为NO,A可与O2反应生成NO,反应的化学方程式为N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,
故答案为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
②D为HNO3,稀溶液具有强氧化性,可与Cu发生氧化还原反应生成硝酸铜和NO,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
点评 本题考查无机物的推断,题目难度中等,本题注意根据物质的颜色以及连续发生氧化反应的特征为突破口进行推断.


科目:高中化学 来源: 题型:解答题
 CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用.
CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次数 | 测量项目 | 测量数据(mg/mL) |
| 1 | 铜离子含量 | 4.224 |
| 2 | 4.225 | |
| 3 | 4.223 | |
| 4 | 2.005 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b>c | B. | a+b>2c | C. | a+b<c | D. | a+b<2c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 第2周期 | ① | ② | ③ | |||||
| 第3周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 第4周期 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用H++OH-═H2O來测量某氢氧化钠溶液的浓度时:甲基橙--橙色 | |
| B. | 利用“2Fe3++2I-═I2+2Fe2+,用NaI溶液测量Fe(NO3)3样品中Fe(NO3)3百分含量:淀粉--蓝色 | |
| C. | 利用“Ag++SCN-=AgSCN↓原理,可用标准KSCN溶液含量AgNO3溶液浓度:Fe(NO3)3--血 红色 | |
| D. | 用标准酸性KMnO4溶液滴定NaHSO3溶液以测量其浓度:KMnO4--紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日常生活中的陶瓷、水泥、玻璃等是使用量最大的无机非金属材料 | |
| B. | 制饭勺、高压锅等的不锈钢是合金.合金有许多优良的性能,如熔点比成分金属高 | |
| C. | 防止或减少雾霾形成的措施之一是减少煤的燃烧和机动车的使用 | |
| D. | 食品干燥剂应无毒、无味、无腐蚀性及环境友好,硅胶可用作食品干燥剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com