
【题目】对于化学反应的限度的叙述,错误的是
A.化学反应的限度与时间的长短无关
B.化学反应达到限度时,正、逆反应速率相等
C.化学反应的限度是不可改变的
D.任何可逆反应都有一定的限度
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2(g)+3H2(g)![]() 2NH3(g)已达到平衡状态的是
2NH3(g)已达到平衡状态的是
①1个N![]() N键断裂的同时,有3个H-H键断裂 ②1个N
N键断裂的同时,有3个H-H键断裂 ②1个N![]() N键断裂的同时,有6个N-H键断裂 ③其他条件不变时,混合气体平均相对分子质量不再改变 ④恒温恒容时,体系压强不再改变 ⑤NH3、N2、H2的体积分数都不再改变 ⑥恒温恒容时,混合气体的密度保持不变 ⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
N键断裂的同时,有6个N-H键断裂 ③其他条件不变时,混合气体平均相对分子质量不再改变 ④恒温恒容时,体系压强不再改变 ⑤NH3、N2、H2的体积分数都不再改变 ⑥恒温恒容时,混合气体的密度保持不变 ⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示的实验设计能达到相应实验目的的是
A. 检验溴乙烷消去的产物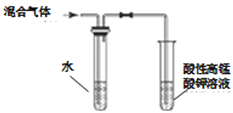
B. 检验FeCl3溶液中是否混有Fe2+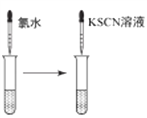
C. 检验亚硫酸钠溶液是否变质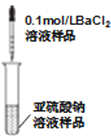
D. 验证钢铁的析氢腐蚀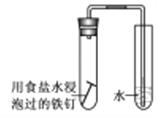
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HA为一元弱酸。已知溶液中HA、A-的物质的量分数δ随溶液pH变化的曲线如右图所示。向10mL0.1mol/LHA溶液中,滴加0.1mol/LNaOH溶液x mL。下列不正确的是
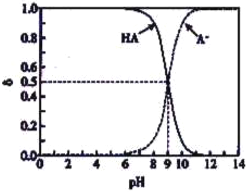
A. 常温下,HA的电离平衡常数Ka=10-9 B. x=0时,1<pH<7
C. x=5时,C(A-)=c(HA) D. x=10时,c(A-)+c(HA)=c(Na+)=0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某气态平衡体系的平衡常数表达式为K=![]() ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A. 升高温度,平衡常数K一定增大
B. 增大A浓度,平衡向正反应方向移动
C. 增大压强,C体积分数增加
D. 升高温度,若B的百分含量减少,则正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用石灰石与稀盐酸反应制取二氧化碳,为了降低其反应速率,下列措施可行的是( )
A. 使用浓盐酸 B. 向反应体系中加入氯化钙晶体
C. 提高反应温度 D. 向反应体系中加入蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液。请回答下列问题:
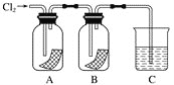
(1)通氯气一段时间后,A中观察到的现象是______________________________,B中观察到的现象是_________________,由此可得出的结论是____________________________,写出有关反应的化学方程式:____________________。
(2)C装置的作用是____________________,理由是_______________________________,写出有关反应的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五水硫酸铜(CuSO4·5H2O)和六水硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]都是重要的化工原料,用途十分广泛。
请回答与这两种物质中元素有关的一些问题。
(1)基态铁原子的核外电子排布式为_______;基态铜原子的电子占据的最高能层符号为_______ 。
(2)氧元素的第一电离能小于氮元素,其原因是_______ 。
(3)SO42-、H2O、NH4+三种微粒中,空间构型为正四面体的是_______;NH4+中氮原子的杂化轨道类型是_______。
(4)写出与SO42-互为等电子体的分子的化学式_______ (写一种)。
(5)Cu与Au的合金可形成面心立方最密堆积的晶体,在该晶胞中Cu原子处于面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为_______,若该晶体的密度为ρg.cm-3,则晶胞中Cu原子与Au原子中心的最短距离d=_______cm(NA表示阿伏加德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏伽德罗常数的数值为,下列叙述正确的是( )
A.标准状况下,22.4L四氯化碳含有的分子数为NA
B.1 mol硫酸钾中阴离子所带的电荷数为2NA
C.0.5 molL﹣1NaOH溶液中 Na+数为0.5NA
D.常温常压下,16g氧气所含电子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com