
【题目】A、B、C、D、E、F六种短周期元素,其原子序数依次增大。A原子的最外层电子数是次外层电子数的2倍,C的氢化物在常温下为液体,D能形成DF型离子化合物,0.9 g E与足量的稀硫酸反应生成的氢气在标准状况下的体积为1.12 L,F的族序数与周期序数之差为4。请回答下列问题:
(1)写出元素符号:A________;B________; F_________。
(2)六种元素中,单质还原性最强的是______(写化学式,下同);最高价氧化物对应水化物中酸性最强的酸是__________。
(3)写出C与D形成的原子个数比为1:1的化合物的电子式:______所含化学键类型为______。
(4)六种元素中的三种元素组成的某种盐的水溶液呈碱性,是家用消毒剂的主要成分,请用离子方程式解释该盐溶液呈碱性的原因:_____________。
(5)D、E元素的最高价氧化物对应的水化物发生反应的离子方程式为_________。
(6)写出用惰性电极电解饱和DF溶液的化学方程式:_________________。
【答案】 C N Cl Na HClO4 ![]() 离子键、共价键 ClO-+H2O====HClO+OH- Al(OH)3+OH-=====AlO2-+2H2O 【答题空10】2NaCl+2H2O
离子键、共价键 ClO-+H2O====HClO+OH- Al(OH)3+OH-=====AlO2-+2H2O 【答题空10】2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
【解析】A、B、C、D、E、F六种短周期元素,其原子序数依次增大。A原子的最外层电子数是次外层电子数的2倍,A是碳元素;C的氢化物在常温下为液体,C为氧元素,B为氮元素;0.9 g E与足量的稀硫酸反应生成的氢气在标准状况下的体积为1.12 L,生成氢气的物质的量为0.05mol,0.9 g E失电子0.1mol,E摩尔电子质量为9g,符合条件的元素为铝;F的族序数与周期序数之差为4,得出F为氯元素;D能形成DF型离子化合物,故D为钠元素。
(1)元素符号:A:C;B:N; F:Cl。(2)六种元素中,钠原子半径最大,单质还原性最强的是Na;氯元素的非金属性最强,最高价氧化物对应水化物中酸性最强的酸是HClO4 ;(3)C与D形成的原子个数比为1:1的化合物为过氧化钠,电子式:![]() ,O22-离子内部两个氧形成共价键,和Na+之间形成离子鍵;(4)六种元素中的三种元素组成的某种盐的水溶液呈碱性,是家用消毒剂的主要成分,该物质是NaClO,是强碱弱酸盐,水解后呈碱性,ClO-+H2O
,O22-离子内部两个氧形成共价键,和Na+之间形成离子鍵;(4)六种元素中的三种元素组成的某种盐的水溶液呈碱性,是家用消毒剂的主要成分,该物质是NaClO,是强碱弱酸盐,水解后呈碱性,ClO-+H2O![]() HClO+OH-;(5)D、E元素的最高价氧化物对应的水化物分别是Al(OH)3和NaOH,发生反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;(6)用惰性电极电解饱和NaCl溶液生成氢氧化钠、氢气和氯气,化学方程式: 2NaCl+2H2O
HClO+OH-;(5)D、E元素的最高价氧化物对应的水化物分别是Al(OH)3和NaOH,发生反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;(6)用惰性电极电解饱和NaCl溶液生成氢氧化钠、氢气和氯气,化学方程式: 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】把下列四种X溶液分别加入四个盛有10 mL 2 mol/L盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10 ℃,20 mL 3 mol/L 的X溶液
B.20 ℃,30 mL 2 mol/L的X溶液
C.20 ℃,10 mL 4 mol/L的X溶液
D.10 ℃,10 mL 2 mol/L的X溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是
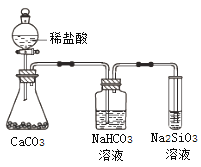
A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是
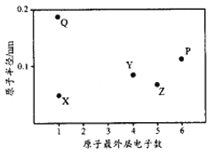
A. Q的氧化物一定含有离子键和共价键 B. 最高价含氧酸的酸性:Z<Y
C. P的最低价氢化物常温常压下为液体 D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 ![]() Zn高能原子轰击
Zn高能原子轰击 ![]() Pb的靶子,使锌核与铅核熔合,生成一个 112 号元素原子的同时向外释放出一个中子.下列说法错误的是( )
Pb的靶子,使锌核与铅核熔合,生成一个 112 号元素原子的同时向外释放出一个中子.下列说法错误的是( )
A.此反应不属于化学变化
B.112 号元素的相对原子质量为 227
C.科学家合成的 112 号元素的原子的中子数为 165
D.112 号元素属于第七周期元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定体积的N2、O2、CO2混合气体通过足量的Na2O2后,同温同压下体积变为原来的0.75倍,原混合气体中N2、O2、CO2物质的量之比可能为
A.1∶1∶2B.4∶3∶5C.1∶2∶1D.6∶7∶14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为
A. 1.5 mol B. 2.5 mol C. 1.0 mol D. 0.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸雨被称为“天堂的眼泪”,会造成水土酸性化、建筑物加速腐蚀等危害。下列有关说法正确的是
A. 酸雨是指pH值<7的雨水,酸雨长时间放置,酸性变强
B. NO2与SO2的过度排放是形成酸雨的主要原因
C. 使用新型能源不会对酸雨的防治产生效果
D. 酸雨不会对动物的健康产生任何影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com