
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | F | Ne | |||||
| 3 | Na | Mg | Al | Si | Cl |
 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
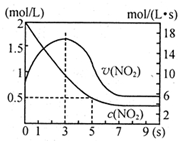 某绝热恒容容器中充入2mol/L NO2,发生反应2NO2?N2O4 △H=-56.9kJ/mol下列分析不正确的是( )
某绝热恒容容器中充入2mol/L NO2,发生反应2NO2?N2O4 △H=-56.9kJ/mol下列分析不正确的是( )| A、5s时NO2的转化率为75% |
| B、0-3s时v(NO2)增大是由于体系温度升高 |
| C、3s时化学反应处于平衡状态 |
| D、9s时再充入N2O4,平衡后K较第一次平衡时大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含Mg2+、Al3+、Cl-,不含Na+、NH4+ |
| B、一定含Na+、Mg2+、Cl-,不含NH4+,可能含有Al3+ |
| C、c(Cl-)为4.0mol/L,c(Al3+)为1.0mol/L |
| D、c(Mg2+)为1.0mol/L,c(Na+)为0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
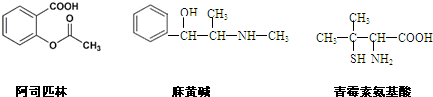
| A、三种有机物都能发生酯化反应 |
| B、阿司匹林能与NaOH溶液反应生成可溶性有机物 |
| C、麻黄碱的分子式是C10H15NO,苯环上的一氯代物有3种 |
| D、青霉素氨基酸不能与盐酸反应,但能与NaOH溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com