
A、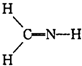 |
B、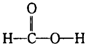 |
C、 |
D、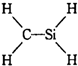 |
 中每个氢原子能形成1个共价键,氮原子能形成3个共价键,碳原子能形成4个共价键,所以每个原子都达到稳定结构,故A正确;
中每个氢原子能形成1个共价键,氮原子能形成3个共价键,碳原子能形成4个共价键,所以每个原子都达到稳定结构,故A正确; 中碳原子能形成4个共价键,氧原子能形成2个共价键,从而使各个原子能达到稳定结构,故B正确;
中碳原子能形成4个共价键,氧原子能形成2个共价键,从而使各个原子能达到稳定结构,故B正确; 中每个碳原子能形成4个共价键,氢原子能形成1个共价键,氧原子能形成2个共价键,从而使各个原子能达到稳定结构,故C正确;
中每个碳原子能形成4个共价键,氢原子能形成1个共价键,氧原子能形成2个共价键,从而使各个原子能达到稳定结构,故C正确; 中碳原子、硅原子成键情况不合理,故D错误;
中碳原子、硅原子成键情况不合理,故D错误;

科目:高中化学 来源: 题型:
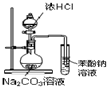 |
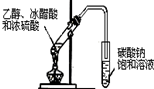 |
| A.证明酸性:盐酸>碳酸>苯酚 | B.实验室制取乙酸乙酯 |
 |
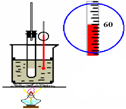 |
| C.石油分馏 | D.实验室制取硝基苯 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、卤素单质从F2到I2,熔沸点依次升高,是因为其分子间作用力逐渐增大 |
| B、卤族元素从Cl到I,最高价氧化物对应水化物的酸性减弱 |
| C、卤族元素从F到I,HX水溶液酸性增强 |
| D、卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质均可将排在后面的卤素从它的盐溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2是有刺激性气味的有毒气体,易溶于水,部分与水发生化学反应 |
| B、不法商贩就有燃烧硫磺对年糕和笋干进行熏制,这是利用SO2的漂白性 |
| C、浓硫酸在与蔗糖反应得到“黑面包”,只体现浓硫酸的脱水性 |
| D、浓硫酸可用铁制的槽车运输,是因为常温下浓硫酸能使铁钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n=3时,则分子的立体构型为V形 |
| B、n=2时,则分子的立体构型平面三角形 |
| C、n=4时,则分子的立体构型为正四面体形 |
| D、n=4时,则分子的立体构型为三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| B、某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
| C、AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不相同 |
| D、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)<c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com