
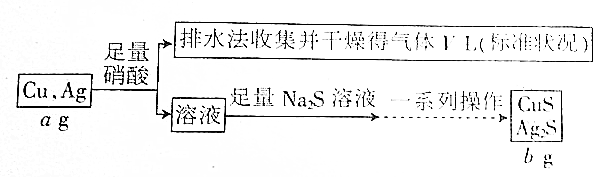
| A. | V L气体是NO | |
| B. | 一系列操作指“过滤、洗涤、烘干” | |
| C. | 上述数据之间的关系有b=$\frac{7a+15v}{7}$ | |
| D. | 根据上述数据能计算合金中铜的质量分数 |
分析 根据流程可知:铜银合金与足量硝酸反应生成硝酸铜、硝酸银溶液、NO或NO2气体,用排水法收集到的VL气体为NO;向反应后的溶液中加入硫化钠溶液,反应生成硫化铜、硫化银沉淀,过滤后得到硫化铜、硫化银固体,然后洗涤、干燥,最后得到干燥的硫化铜、硫化银固体.
解答 解:A.二氧化氮与水反应生成一氧化氮,则用排水法收集到的VL气体为NO,故A正确;
B.根据分析可知,反应生成硫化银沉淀,过滤后得到硫化银固体,然后洗涤、干燥,最后得到干燥的硫化银固体,故B正确;
C.没有告诉硝酸的浓度,合金与硝酸反应放出的气体中可能含有NO2气体,故C错误;
D.根据铜银合金的质量为ag,硫化铜、硫化银的质量为bg,可计算合金中铜的质量分数,故D正确.
故选C.
点评 本题考查化学实验方案的评价,对实验原理的理解、物质组成的测定等,难度中等,理解原理是关键,需要学生具有扎实的基础知识与综合运用知识分析解决问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液腐蚀铜片:Fe3++Cu═Fe2++Cu2+ | |
| B. | 氯气和烧碱溶液反应:Cl2+OH-═Cl-+HClO | |
| C. | 碳酸钙和醋酸反应:CaC03+2H+═CO2↑+Ca2++H2O | |
| D. | 氢氧化铝与稀硫酸反应:Al(OH)3+3H+═3H2O+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
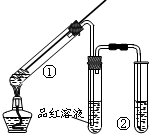
| A. | 品红溶液的作用是吸收SO2,防止污染空气 | |
| B. | 试管②中盛放的试剂通常是NaOH溶液 | |
| C. | 试管①中有白色固体生成,向①中加水后溶液呈蓝色 | |
| D. | 该反应中浓硫酸既表现了强氧化性,又表现了酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大(填越大、越小),K值大小与温度的关系是:温度升高,K值可能增大也可能减小.(填一定增大、一定减小、或可能增大也可能减小);
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大(填越大、越小),K值大小与温度的关系是:温度升高,K值可能增大也可能减小.(填一定增大、一定减小、或可能增大也可能减小);查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5mol•L-1 | B. | 2.5mol•L-1? | C. | 2.1mol•L-1 | D. | 1.27mol•L-1? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com