
 ,其中S原子轨道的杂化类型是sp3,它是极性(填“极性”或“非极性”)分子.
,其中S原子轨道的杂化类型是sp3,它是极性(填“极性”或“非极性”)分子.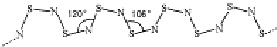
分析 (1)硫原子最外层有6个电子,和氟原子之间有6对完全相同的成键电子对;根据S原子的核外电子排布式确定未成对电子数;
(2)价层电子对数=σ键个数+孤电子对数,根据价层电子对数确定其杂化类型;
如果分子中正负电荷中心重合的分子为非极性分子,否则为极性分子,先判断其分子空间构型,然后确定是否是非极性分子;
(3)①根据晶体的构成微粒确定晶体类型,由分子构成的晶体为分子晶体,由原子构成的晶体为原子晶体;
②先设出[(SN)200]、[(SN)300]物质的量分别为xmol、ymol,利用题中缩合产物中二百聚物的质量分数为0.50和氮原子守恒列出二元一次方程进行计算;
根据S守恒,生成600二百聚物和400三百聚物,失去了1.20×105 mol N2,同时有2.4×105molS生成了硫化银,生成Ag2S就需要4.8×105molAg,算出这些Ag的质量.而现在只有8.64kg,二者相比就可以知道需要银循环的次数;
(4)在Ag晶体的一个晶胞中与它距离相等且最近的Ag原子在通过这个顶点的三个面心上,面心占$\frac{1}{2}$,通过一个顶点可形成8个晶胞;
(5)由于H2SO4中S的化合价为+6价,H2SO3中S为+4价,所以H2SO4中S的正电性高于H2SO3中S的正电性,导致羟基上O原子的电子偏向S,在水分子的作用下就更容易电离出H+,即酸性更强.
解答 解:(1)SF6中每一个S-F键含有一个成键电子对,所以SF6中含有6个S-F键,则分子中有6对完全相同的成键电子对,元素S基态原子核外电子排布式为1s22s22p63s23p4,基态S原子核外处在能量最高的能级为3p,排布了4个电子,根据泡利原理和洪特规则,可知在3p上存在2个未成对电子,故答案为:6;2;
(2)S2Cl2分子中每个S原子价层电子对数=2+2=4,所以采取sp3杂化,S2Cl2的结构类似于H2O2的结构,为Cl-S-S-Cl,其中的S-S为非极性键,S-Cl键为极性键,但正负电荷中心不重合,所以是极性分子,故答案为:sp3;极性;
(3)①S4N4的晶体是由分子构成的,属于分子晶体,故答案为:分子;
②设[(SN)200]、[(SN)300]物质的量分别为xmol、ymol,利用缩合产物中二百聚物的质量分数为0.50,列式为46×200x÷(46×200x+46×300y)=0.5,氮原子守恒列式 200x+300y=1.20×105×4-1.20×105×2,解得x=600mol,y=400ml,即二百聚物为600mol,三百聚物为400mol;
根据S守恒,生成600二百聚物和400三百聚物,失去了1.20×105 mol N2,同时有2.4×105molS减少,生成了硫化银,生成 2.4×105mol Ag2S,就需要消耗4.8×105molAg,所以Ag的循环使用次数为:4.8×105÷(8.64×1000÷108)=6000(次),故答案为:400mol;6000;
(4)该晶胞中Ag原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,其配位数=3×8×$\frac{1}{2}$,晶胞边长a=4.08×10-10 m,晶胞体积=(4.08×10-7cm)3,密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{108}{{N}_{A}}×4}{(4.08×1{0}^{-7})^{3}}$,
故答案为:$\frac{\frac{108}{{N}_{A}}×4}{(4.08×1{0}^{-7})^{3}}$;
(5)由于H2SO4中S的化合价为+6价,H2SO3中S为+4价,H2SO4和H2SO3分别表示为(HO)2SO2和(HO)2SO,H2SO4分子中非羟基氧原子数多,中心硫原子的正电性高,导致S-O-H中的O原子的电子更向S原子偏移,越易电离出H+,即酸性越强,
故答案为:H2SO4和H2SO3分别表示为(HO)2SO2和(HO)2SO,H2SO4分子中非羟基氧原子数多,中心硫原子的正电性高,导致S-O-H中的O原子的电子更向S原子偏移,越易电离出H+.
点评 本题考查了分子空间构型的判断、杂化方式的判断、晶体类型的判断、原子杂化方式判断、化学键和分子间作用力和晶胞的计算等知识点,明确晶体构成微粒与晶体类型的关系、价层电子对互斥理论即可解答.


科目:高中化学 来源: 题型:选择题
| A. | 碳和水反应吸收131.3kJ能量 | |
| B. | 1mol碳和1mol水反应生成 一氧化碳和氢气,并吸收131.3kJ热量 | |
| C. | 1mol C(S)和1 mol H2O(g)的能量总和大于1mol H2(g)和1mol CO(g)的能量 | |
| D. | 1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将标准状况下1.12 L NH3溶于500 mL水中 | |
| B. | 将标准状况下1.12 L NH3溶于水配成500 mL溶液 | |
| C. | 取1 mol•L-1的氨水50 mL,加入500 mL水中 | |
| D. | 取1 mol•L-1的氨水100 mL,配成1 000 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
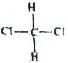 和
和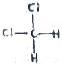
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数是254 | B. | 质量数是102 | C. | 中子数是152 | D. | 电子数是254 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 、G
、G .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com