



 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源:不详 题型:单选题
A.Na2CO3溶液与NaHSO4溶液反应: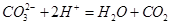 ↑ ↑ |
B.向硫酸铵溶液中加入氢氧化钡溶液: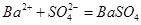 ↓ ↓ |
| C.Fe3O4与稀硝酸反应:Fe3O4 +8H+= 2Fe3++ Fe2+ +4H2O |
| D.少量金属钠加到冷水中:Na +2H2O=Na+ +OH- +H2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+ |
| B.等物质的量的NaHCO3溶液和Ba(OH)2溶液混合:HCO3-+Ba2++OH-= BaCO3↓+H2O |
| C.Na2O2溶于水产生O2:Na2O2+H2O = 2Na++2OH-+O2↑ |
| D.少量AlCl3溶液滴入过量氨水中:Al3++4NH3?H2O= AlO2- +4NH4+ +2 H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.Fe2+ | B.Fe3+ | C.Cl- | D.SO42— E.H2SO3 |
| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
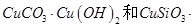
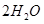 ,同时含有
,同时含有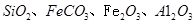 等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图:
等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图: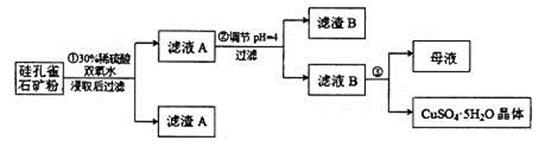
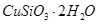 发生反应的化学方程式
发生反应的化学方程式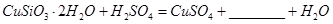 ;
;A.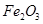 | B.CuO | C.A12O3 | D.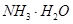 |
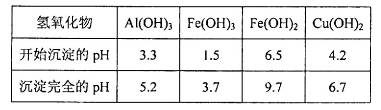
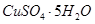 晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,
晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,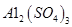 饱和溶液中
饱和溶液中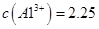 mol
mol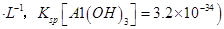 ______________。
______________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[设其主要成分为Cu2(OH)2CO3] |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2 +6H++5H2O2=2Mn2++5O2↑+8H2O +6H++5H2O2=2Mn2++5O2↑+8H2O |
B.将少量SO2通入苯酚钠溶液中:2C6H5O-+SO2+H2O=2C6H5OH+ |
| C.用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-=Fe(SCN)3↓ |
| D.向碘化亚铁溶液中通入过量的氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
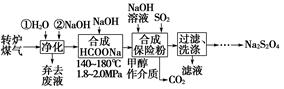
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3—=CaCO3↓+CO32—+2H2O |
| B.磁性氧化铁置于氢碘酸溶液中:Fe3O4+8HI=2Fe3++Fe2++4H2O+8I- |
| C.NaHSO4溶液中滴加过量Ba(OH)2溶液:H++SO42—+Ba2++OH-=BaSO4↓+H2O |
| D.醋酸与氨水混合:CH3COOH+NH3·H2O=CH3COONH4+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com