
分析 (1)由于实验室无950mL容量瓶,故应选择1000mL的容量瓶,故配制出1000mL溶液,根据n=cV和m=nM来计算所需碳酸钠的质量;
(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来对操作步骤进行排序;
(3)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)由于实验室无950mL容量瓶,故应选择1000mL的容量瓶,故配制出1000mL溶液,所需碳酸钠的质量m=CVM=0.1mol/L×1L×106g/mol=10.6g,
故答案为:A;
(2)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序为BCAFED,
故答案为:BCAFED;
(3)①容量瓶中原来存有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故不选;
②溶解后未洗涤烧杯和玻璃棒;导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故不选;
③定容时加水超过了刻度线,用胶头滴管吸出一些溶液使液面达到刻度线,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故不选;
④搅拌或转移溶液时有液体溅出,部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故不选;
⑤给容量瓶定容时,俯视读数,导致溶液体积偏小,溶液浓度偏高,故选;
⑥称取固体时,药品与砝码的位置放反,会导致所称量的溶质的质量偏小,浓度偏低,故不选;
故选:⑤.
点评 本题考查了一定物质的量浓度溶液的配制和误差分析,明确配制原理及操作步骤是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 烷烃 | B. | 烯烃 | C. | 炔烃 | D. | 芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
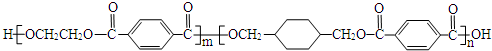
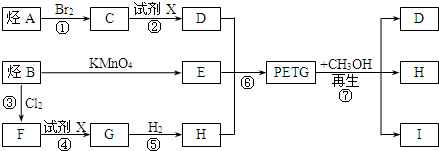
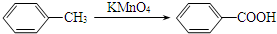
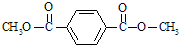 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
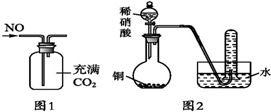
| A. | 汽车尾气中有NOx,主要是汽车打火时氮气和氧气反应引起的 | |
| B. | 可以用图1所示装置收集到干燥的NO气体 | |
| C. | 根据图2装置收集到的气体为无色能够验证铜和稀硝酸反应的产物中气态物质只有NO | |
| D. | 可以用湿润的淀粉碘化钾试纸鉴别红棕色气体NO2和溴蒸气 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
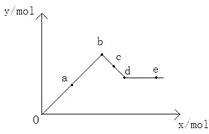
| A. | a-b时沉淀的物质的量:Al(OH)3比BaSO4多 | |
| B. | c-d时溶液中离子的物质的量:AlO2-比Ba2+多 | |
| C. | a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3 | |
| D. | d-e时溶液中离子的物质的量:Ba2+可能等于OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
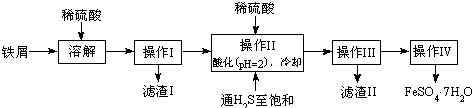
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
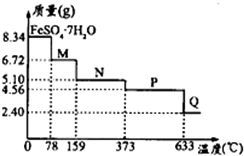
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W 均为中学化学中常见物质或其溶液,一定条件下它们之间有如下转化关系(其它产物已略去),下列说法不正确的是( )
X、Y、Z、W 均为中学化学中常见物质或其溶液,一定条件下它们之间有如下转化关系(其它产物已略去),下列说法不正确的是( )| A. | 若 W 是单质铁,则 Z 溶液可能是 FeCl2 溶液 | |
| B. | 若 X 是碳酸钠,则 W 可能是盐酸 | |
| C. | 若 W 是氢氧化钠,则 X 与 Z 可反应生成 Y | |
| D. | 若 W 为氧气,则 Z 与水反应(或溶于水)一定生成一种强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
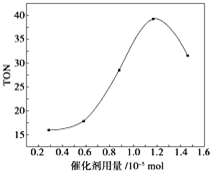
| A. | 由甲醇和CO2直接合成碳酸二甲酯,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义 | |
| B. | 在反应体系中添加合适的吸水剂,将提高该反应的TON | |
| C. | 当催化剂用量为1.2×10-5mol时,该反应的TON 达到最高点 | |
| D. | 当催化剂用量高于1.2×10-5mol时,随着催化剂用量的增加,甲醇的平衡转化率逐渐降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时每转移3mol电子,正极有1molK2FeO4被氧化 | |
| B. | 放电时负极反应为Zn+2e-+2OH-═Zn(OH)2 | |
| C. | 充电时阳极反应为Fe(OH)3-3e-+5OH-═FeO42-+4H2O | |
| D. | 放电时正极附近溶液的碱性减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com