
(14 分)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)判断BaCl2 已过量的方法是____________________________
(2)第④步中,相关的离子方程式是____________________________
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是______________
(4)为检验精盐纯度,需配制150mL0.2mol·L-1NaCl(精盐)溶液,如图是该同学 转移溶液的示意图,图中的错误是________________________________。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
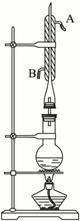
①向圆底烧瓶中加入几粒碎瓷片,并注入0.14 mol异戊醇和0.35 mol冰醋酸,再加入4 mL浓H2SO4至不再分层。
②在烧瓶上安装冷凝回流装置,加热混合物1小时后,冷却至室温。
③把混合物转至分液漏斗中,加少量蒸馏水,振荡分层后除去水层,再用蒸馏水洗涤有机层。
④用5%的NaHCO3溶液分几次洗涤产品直至中性。
⑤向上述溶液中加NaCl晶体,搅拌静置,对液体进行分液。
⑥将粗产品转至蒸馏烧瓶中,加入碎瓷片,并加适量无水MgSO4或Mg(NO3)2蒸馏,收集
试完成下列问题:
(1)冷凝管中冷却水流向是由_____________进入,由____________流出。(填“A”或“B”)
(2)圆底烧瓶中的物质_______________(填“会”或“不会”)从冷凝管上口跑掉,是因为_________________________________________________________________。
(3)合成实验中浓H2SO4的作用是____________________________________________,碎瓷片的作用是_________________________________________________________。
(4)乙酸与异戊醇的物质的量之比0.35∶0.14>1∶1的原因是_______________________。
(5)在③中用蒸馏水多次洗涤的作用是_______________________________________。④中用NaHCO3溶液洗涤产品的作用是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室利用右图所示装置制取乙酸异戊酯,其合成过程为:
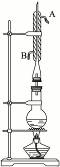
①向圆底烧瓶中加入几粒碎瓷片,并注入0.14 mol异戊醇和0.35 mol冰醋酸,再加入4 mL浓H2SO4至不再分层。
②在烧瓶上安装冷凝回流装置,加热混合物1小时后,冷却至室温。
③把混合物转至分液漏斗中,加少量蒸馏水,振荡分层后除去水层,再用蒸馏水洗涤有机层。
④用5%的NaHCO3溶液分几次洗涤产品直至中性。
⑤向上述溶液中加NaCl晶体,搅拌静置,对液体进行分液。
⑥将粗产品转至蒸馏烧瓶中,加入碎瓷片,并加适量无水MgSO4或Mg(NO3)2蒸馏,收集135 ℃—143 ℃之间的馏分。
试完成下列问题:
(1)冷凝管中冷却水流向是由_____________进入,由____________流出。(填“A”或“B”)
(2)圆底烧瓶中的物质_______________(填“会”或“不会”)从冷凝管上口跑掉,是因为
_____________________________________________________________________________。
(3)合成实验中浓H2SO4的作用是____________________________________________,碎瓷片的作用是__________________________________________________________________。
(4)乙酸与异戊醇的物质的量之比0.35∶0.14>1∶1的原因是_______________________。
(5)在③中用蒸馏水多次洗涤的作用是_______________________________________。④中用NaHCO3溶液洗涤产品的作用是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室利用右图所示装置制取乙酸异戊酯,其合成过程为:

①向圆底烧瓶中加入几粒碎瓷片,并注入0.14mol异戊醇和0.35mol冰醋酸,再加入4 mL浓H2SO4至不再分层。
②在烧瓶上安装冷凝回流装置,加热混合物1小时后,冷却至室温。
③把混合物转至分液漏斗中,加少量蒸馏水,振荡分层后除去水层,再用蒸馏水洗涤有机层。
④用5%的NaHCO3溶液分几次洗涤产品直至中性。
⑤向上述溶液中加NaCl晶体,搅拌静置,对液体进行分液。
⑥将粗产品转至蒸馏烧瓶中,加入碎瓷片,并加适量无水MgSO4或Mg(NO3)2蒸馏,收集135 ℃—143 ℃之间的馏分。
试完成下列问题:
(1)冷凝管中冷却水流向是由_____________进入,由____________流出。(填“A”或“B”)
(2)圆底烧瓶中的物质_______________(填“会”或“不会”)从冷凝管上口跑掉,是因为
_____________________________________________________________________________。
(3)合成实验中浓H2SO4的作用是____________________________________________,碎瓷片的作用是__________________________________________________________________。
(4)乙酸与异戊醇的物质的量之比0.35∶0.14>1∶1的原因是_______________________。
(5)在③中用蒸馏水多次洗涤的作用是_______________________________________。④中用NaHCO3溶液洗涤产品的作用是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(14 分)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)判断BaCl2 已过量的方法是____________________________
(2)第④步中,相关的离子方程式是____________________________
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是______________
(4)为检验精盐纯度,需配制150mL0.2mol·L-1NaCl(精盐)溶液,如图是该同学 转移溶液的示意图,图中的错误是________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com