
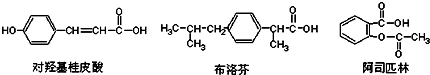
| A. | 三种有机物都能发生水解反应 | |
| B. | 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 | |
| C. | 三种物质中,其中有两种互为同分异构体 | |
| D. | 三种物质在一定条件下,均可以被氧化反应 |
分析 A.含有酯基、氯原子或肽键的有机物能发生水解反应;
B.根据苯环上氢原子种类确定其苯环上氢原子被氯原子取代产物种类;
C.分子式相同结构不同的有机物互为同分异构体;
D.含有C、H、O元素的有机物在一定条件下都能被氧化.
解答 解:A.含有酯基、氯原子或肽键的有机物能发生水解反应,对羟基桂皮酸和布洛芬都不能发生水解反应,故A错;
B.根据苯环上氢原子种类确定其苯环上氢原子被氯原子取代产物种类,阿司匹林苯环上有4种氢原子,所以其苯环上的氢原子若被氯原子取代,其一氯代物有4种,故B错误;
C.分子式相同结构不同的有机物互为同分异构体,这三种物质都不是同分异构体,故C错误;
D.含有C、H、O元素的有机物在一定条件下都能被氧化,这三种有机物都属于烃的含氧衍生物,在一定条件下都能被氧化,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查基本概念、同分异构体种类判断等知识点,易错选项是B.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
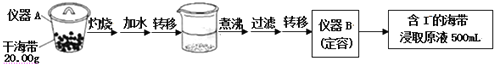
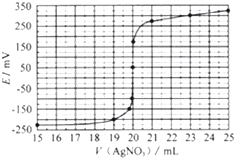
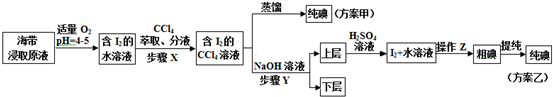
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Pb为正极,发生氧化反应 | B. | SO42-只向正极移动 | ||
| C. | 电解质溶液密度不断减小 | D. | 溶液的pH不断减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不确定 | B. | 变小 | C. | 不变 | D. | 变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3 | B. | Fe3O4 | C. | Fe4O5 | D. | Fe5O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M一定是强电解质 | B. | M一定是弱电解质 | C. | M一定是某种盐 | D. | M一定是某种强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生氧化反应的是H2C2O4 | |
| B. | 离子方程式右侧方框内的产物是H2O | |
| C. | 每消耗6 mol H+,转移5 mol电子 | |
| D. | 还原性:Mn2+<H2C2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com