
 X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如表:
X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如表:| 元素代号 | X | Y | Z | M | Q | R |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
 .
.分析 短周期元素,由元素的化合价可知,Z、Q均有-2价,且Z有+6价,原子半径较大,故Q为O元素、Z为S元素;X、M均有+2价,处于ⅡA族,且X原子半径较大,故X为Mg、M为Be;R为+1价,原子半径小于O,故R为H元素;Y有+3价,处于ⅢA族,原子半径大于S,故Y为Al,据此解答.
解答 解:短周期元素,由元素的化合价可知,Z、Q均有-2价,且Z有+6价,原子半径较大,故Q为O元素、Z为S元素;X、M均有+2价,处于ⅡA族,且X原子半径较大,故X为Mg、M为Be;R为+1价,原子半径小于O,故R为H元素;Y有+3价,处于ⅢA族,原子半径大于S,故Y为Al.
(1)Y为Al,在元素周期表中的位置是:第三周期ⅢA族,故答案为:第三周期ⅢA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Mg2+>Al3+,故答案为:O2-;
(3)①Q和R按原子个数比1:1组成的化合物甲,是一种“绿色”氧化剂,甲为H2O2,电子式为 ,故答案为:
,故答案为: ;
;
②在碱性溶液中,将空气中的氧气还原得到H2O2和稀碱的溶液,氧气发生还原反应得到H2O2,通入空气的电极为电解池阴极,则b为电源负极,a为电源的正极,故答案为:正.
点评 本题考查结构性质位置关系应用,关键是根据化合价与原子半径推断元素,注意对元素周期律的理解掌握.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:填空题
 实验室里要配制465mL 0.2mol/L的硫酸钠溶液.
实验室里要配制465mL 0.2mol/L的硫酸钠溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL | B. | 200 mL | C. | 300 mL | D. | 400 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| B. | 石油裂解、煤的气化、海水制镁等过程中都包含化学变化 | |
| C. | 煤经气化、液化和干馏三个物理变化过程,可变为清洁能源 | |
| D. | 通过化学变化可以实现235U与238U的相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
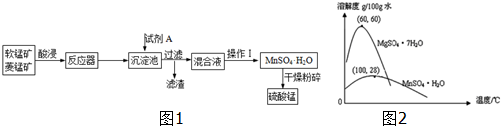
| A. | 试剂A应该选择H2O2,目的是将Fe2+氧化为Fe3+ | |
| B. | 试剂A应该选择氨水,目的是调节溶液的pH | |
| C. | 操作I包括蒸发、冷却、结晶、趁热过滤、洗涤、等步骤,洗涤时可用稀硫酸做洗液 | |
| D. | 在蒸发结晶时,温度应该高于60°C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
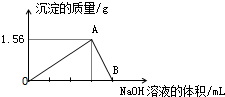 向40mL某AlCl3溶液中滴加2mol•L-1的NaOH溶液时,得到Al(OH)3沉淀的质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
向40mL某AlCl3溶液中滴加2mol•L-1的NaOH溶液时,得到Al(OH)3沉淀的质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com