
分析 根据盖斯定律律①×2-③+②×4构造目标热化学方程式,反应热也乘以相应的系数并进行相应的加减即可,据此进行计算.
解答 解:已知:①CO(g)+1/2O2(g)=CO2(g)△H1=-283.0kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H.2=-285.8kJ/mol,
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H3=-1370kJ/mol,
根据盖斯定律①×2-③+②×4得:2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)△H.=2△H1-△H3+4△H2;
故△H.4=2△H1-△H3+4△H2=2×(-283.0kJ/mol)-(-1370kJ/mol)+4×(-285.8kJ/mol)=-339.2kJ/mol,
故答案为:-339.2 kJ/mol.
点评 本题考查根据盖斯定律进行的有关反应热的计算,题目难度中等,注意理解盖斯定律,关键是构造目标热化学方程式,试题培养了学生的分析能力及化学计算能力.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
| t/s | 0 | 500 | 1 000 |
| c(H2)/mol•L-1 | 5.00 | 3.52 | 2.48 |
| c(CO)/mol•L-1 | 2.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
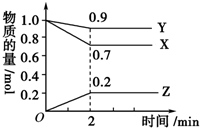 某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为Y+3X?2Z,反应开始至2min,X的转化率为30%.
某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为Y+3X?2Z,反应开始至2min,X的转化率为30%.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 键能:H-F>H-Cl>H-Br>H-I | |
| B. | 还原性:Cl-<Br-<Fe2+<I- | |
| C. | 反应热:C(s)+O2(g)=CO2(g)△H1CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2△H1>△H2 | |
| D. | 酸性:向次氯酸钠溶液中通入少量的二氧化碳,发生ClO-+CO2+H2O=HCO${\;}_{3}^{-}$+HClO则说明酸性:H2CO3>HClO>HCO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 取某溶液少许,加入酸化的Ba(NO3)2溶液,产生白色沉淀 | 该溶液一定含SO42- |
| B | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| C | 某溶液加入盐酸产生使石灰水变浑浊的无色无味气体 | 该溶液肯定含HCO3-、CO32-中的一种或二种 |
| D | 测定等浓度的Na2CO3和Na2SO3溶液的pH;前者pH比后者的大; | 非金属性:S>C |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
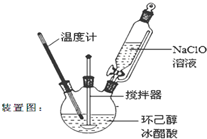 环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为:
环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为: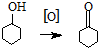
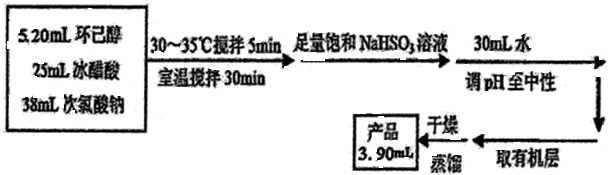
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
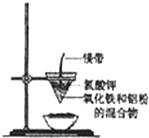 研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:
研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com