
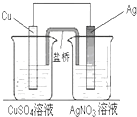
 用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是 ( )
用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是 ( )| A. | ①② | B. | ③④ | C. | ①②④ | D. | ①②③④ |
分析 该装置中,Cu易失电子而作负极、Ag作正极,负极上Cu失电子发生氧化反应、正极上银离子得电子发生还原反应,外电路中电子从负极沿导线流向正极,盐桥中阳离子向正极区域移动、阴离子向负极区域移动,据此分析解答.
解答 解:该装置中,Cu易失电子而作负极、Ag作正极,
①在外电路中,电子从负极沿导线流向正极,所以电子由铜电极流向银电极,故正确;
②正极上银离子得电子发生还原反应,正极反应为:Ag++e-═Ag,故正确;
③盐桥中阳离子向正极区域移动、阴离子向负极区域移动,所以盐桥中K+移向AgNO3溶液,故错误;
④将铜片浸入AgNO3溶液中发生的化学反应为Cu和硝酸银的置换反应,该原电池反应也是Cu和硝酸银的置换反应,所以将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同,故正确;
故选C.
点评 本题考查原电池原理,为高频考点,明确正负极判断方法及各个电极上发生的反应是解本题关键,易错点是判断盐桥中阴阳离子移动方向,注意:电子不进入电解质溶液,题目难度不大.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
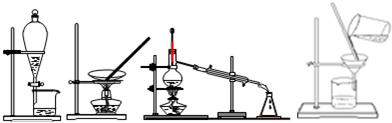
| A. | 过滤、蒸发、蒸馏、萃取 | B. | 过滤、蒸馏、蒸发、萃取 | ||
| C. | 蒸发、蒸馏、过滤、萃取 | D. | 萃取、蒸发、蒸馏、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中熵变小于0、焓变大于0 | |
| B. | 判断反应能否自发进行需要根据△H与△S综合考虑 | |
| C. | 该反应是吸热反应,因此一定不能自发进行 | |
| D. | 碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用图装置验证化学能转化为电能 | B. |  用图装置量取15.00mL KMnO4溶液 | ||
| C. | 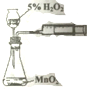 用图装置测定该化学反应速率 | D. | 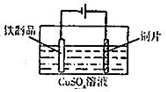 用图装置在铁制品表面镀铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①表示将SO2气体通入溴水中溶液PH值随SO2气体变化关系 | |
| B. | 图②表示反应N2(g)+3H2($?_{催化剂}^{高温、高压}$g)2NH3(g)△H<0的平衡常数K随温度的变化 | |
| C. | 图③中阴、阳两极收集到的气体体积之比一定为1:1 | |
| D. | 图④中的△H1<△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com