
能表示人体大量喝水时,胃液的pH变化的图象是( )
|
| A. |
| B. |
| C. |
| D. |
|
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
甲醛分子式为CH2O,有强烈刺激性气味的气体,甲醛在常温下是气态,被世界卫生组织确定为致癌和致畸形物质.下列关于其结构及性质的分析正确的是( )
|
| A. | C原子采取sp3杂化,O原子采取sp杂化 |
|
| B. | 甲醛分子中心原子价层电子对数为4,含有一对孤电子对,是三角锥形结构 |
|
| C. | 甲醛分子与水分子间可以形成氢键,甲醛分子间不能形成氢键 |
|
| D. | 甲醛分子为非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图所示,其中圆圈表示钛原子,黑点表示碳原子,则它的化学式为( )
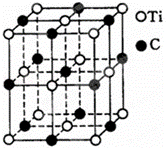
|
| A. | TiC | B. | Ti13C14 | C. | Ti4C7 | D. | Ti14C13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在室温下等体积的酸和碱的溶液,混合后pH值一定小于7的是( )
|
| A. | pH=3的硝酸跟pH=11的氢氧化钾溶液 |
|
| B. | pH=3的盐酸跟pH=11的氨水 |
|
| C. | pH=3的硫酸跟pH=11的氢氧化钠溶液 |
|
| D. | pH=3的醋酸跟pH=11的氢氧化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应2X(g)+Y(g)═2Z(g)+热量,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )
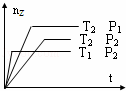
|
| A. | T1<T2,P1<P2 | B. | T1<T2,P1>P2 | C. | T1>T2,P1>P2 | D. | T1>T2,P1<P2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某配位化合物的水溶液为深蓝色,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l2:4:4:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n1)d n+6nsl,回答下列问题。
(1)元素D在周期表中的位置是 。
(2)该配位化合物的化学式为 。
 (3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(4)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 。
(5)已知E的晶胞结构如图所示,则E的配位数 ;EDC4常作电镀液,其中DC 的空间构型是 ,其中D原子的杂化轨道类型是 。
的空间构型是 ,其中D原子的杂化轨道类型是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①上述两种解释中________(填“甲”或“乙”)正确。
②为了验证上述哪种解释正确,继续做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
③若________(填“甲”或“乙”)的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。(已知25 ℃时CH3COONH4溶液呈中性)
(2)有甲、乙两同学做了如下实验:甲同学在制得的Mg(OH)2沉淀中加入浓的NH4Cl溶液,结果沉淀溶解;乙同学在制得的Mg(OH)2沉淀中加入浓CH3COONH4溶液,结果沉淀也完全溶解。对此甲、乙两同学用学过的有关知识各自解释了上述实验事实:
甲同学的解释为:因为NH4Cl溶液中,NH +H2ONH3·H2O+H+,且Mg(OH)2(s)Mg2+(aq)+2OH-(aq);又H++OH-===H2O,所以Mg(OH)2溶解平衡向右移动,促进Mg(OH)2的溶解。
+H2ONH3·H2O+H+,且Mg(OH)2(s)Mg2+(aq)+2OH-(aq);又H++OH-===H2O,所以Mg(OH)2溶解平衡向右移动,促进Mg(OH)2的溶解。
乙同学的解释为:因为CH3COONH4===CH3COO-+NH ,且Mg(OH)2(s)Mg2+(aq)+2OH-(aq),NH
,且Mg(OH)2(s)Mg2+(aq)+2OH-(aq),NH +OH-===NH3·H2O,所以Mg(OH)2溶液平衡向右移动,促进Mg(OH)2的溶解。
+OH-===NH3·H2O,所以Mg(OH)2溶液平衡向右移动,促进Mg(OH)2的溶解。
你认为哪一位同学的解释是正确的?________,为什么?
__________________________________________________________________
_________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com