
【题目】已知海水提取镁的主要步骤如下:
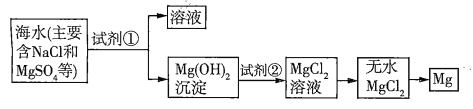
(1)关于加入试剂①作沉淀剂,有以下方法,请完成下列问题。
方法 | 是否合理 | 简述理由 |
方法:高温加热蒸发海水后,再加入沉淀剂 | a | b |
你认为合理的其他方法是c |
a. _____________;
b.____________;
c.____________。
(2)框图中加入的试剂①应该是_______(填物质名称),加入试剂②的溶质是_______(填化学式)。工业上由无水![]() 制取镁的化学方程式为___________。
制取镁的化学方程式为___________。
【答案】不合理 能源消耗大,不经济 向海滩晒盐后得到的苦卤中加入沉淀剂 石灰乳 ![]()
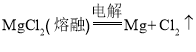
【解析】
(1)高温加热蒸发海水后,再加入沉淀剂,能源消耗大,不经济,可采用向海滩晒盐后得到的苦卤中加入沉淀剂;
(2)试剂①作沉淀剂,生成氢氧化镁沉淀,加入试剂②生成氯化镁,工业制镁采用电解熔融的氯化镁制取,以此分析。
(1)高温加热蒸发海水后,再加入沉淀剂,能源消耗大,不经济,可采用向海滩晒盐后得到的苦卤中加入沉淀剂,
故答案为:不合理;能源消耗大,不经济;向海滩晒盐后得到的苦卤中加入沉淀剂;
(2)试剂①应是石灰乳,发生的反应是![]() ;试剂②应是盐酸,发生的反应是
;试剂②应是盐酸,发生的反应是![]() ,然后经过浓缩、结晶、脱水得无水
,然后经过浓缩、结晶、脱水得无水![]() ,电解再电解熔融的
,电解再电解熔融的![]() 便可制得
便可制得![]() :
: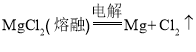 ,
,
故答案为:石灰乳;![]() ;
;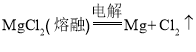 。
。


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】过碳酸钠(2Na2CO3·3H2O2)广泛用于化工、造纸、纺织、食品等行业,一种以芒硝(Na2SO4·10H2O)、H2O2等为原料制备过碳酸钠的工艺流程如下:

已知:2CrO42-+2H+![]() Cr2O72-+H2O,pH小于5时几乎均以Cr2O72-形式存在,pH大于8.5时几乎均以CrO42-形式存在。回答下列问题:
Cr2O72-+H2O,pH小于5时几乎均以Cr2O72-形式存在,pH大于8.5时几乎均以CrO42-形式存在。回答下列问题:
(1)由步骤I可知:Ksp(CaCrO4)_____Ksp(CaSO4)(填“>”或“<”)。
(2)流程中循环物质X的主要溶质为____________(填化学式)。
(3)步骤II后的溶液过滤得到一种酸式盐固体,其发生反应的离子方程式为________________。
(4)步骤III是为了制得纯碱,其化学方程式为 _________________________________。
(5)步骤V合成时,调节温度为15℃并加入95%乙醇的目的是____________________。
(6)测定产品活性氧的实验步骤如下:准确称取mg产品,用硫酸溶解后,用c mol· L-1的KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液V mL。
①该滴定过程不需要外加指示剂的原因是_________________________________ 。
②滴定到终点时,溶液最终呈________(填“无色”或“浅红色”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应A(g)+B(g)C(g)△H<0,达平衡后,在下列空格填入对应图的序号:

(1)升温:______
(2)减压:______
(3)减少C的量:______
(4)增加A的量:______
(5)使用催化剂:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.碳酸氢钠溶液中加入氢氧化钠溶液:HCO3-+OH-=CO2+H2O
B.向次氯酸钾溶液中滴入少量FeSO4溶液;2Fe2++ClO-+2H+=Cl-+2Fe3++H2O
C.Na2S2O3与稀H2SO4混合:S2O32-+2H+=S↓+SO2↑+H2O
D.用石墨电极电解MgCl2溶液:2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是可以综合利用的。从海水中提取食盐和溴的过程如下:

(1)请写出一种海水淡化的方法:__。
(2)步骤Ⅰ获取Br2的离子方程式为___。
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的。其反应的化学方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是__(填化学式)。若反应中生成2molHBr,则消耗___molSO2。
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸工业尾气中的NO、NO2进入大气后,会形成光化学烟雾、破坏臭氧层等。可用氢氧化钠溶液对含氮氧化物的尾气进行处理,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO2+NaNO3+H2O。氨气也可以用来处理氮氧化物。例如,氨气与一氧化氮可发生如下反应:4NH3+6NO=5N2+6H2O。将一定量NO和NO2的混合气体通入300mL5mol/LNaOH溶液中,恰好被完全吸收。下列说法不正确的是
A.在用氨气处理氮氧化物时,氮氧化物发生还原反应
B.所得溶液中NaNO3和NaNO2的物质的量之比可能为2:1
C.若用氨气处理,所需氨气在标准状况下的体积可能为39.2L
D.原混合气体中NO在标准状况下的体积可能为16.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,容积均为2L的密闭容器M、N中,分别有以下列两种起始投料建立的可逆反应 ![]() 的化学平衡状态,相关数据如下:M:
的化学平衡状态,相关数据如下:M:![]() ; 2min达到平衡,生成
; 2min达到平衡,生成![]() ,测得从反应开始到平衡C的速率为
,测得从反应开始到平衡C的速率为![]() ;N:
;N:![]() ;达到平衡时
;达到平衡时![]() 下列推断的结论中不正确的是( )
下列推断的结论中不正确的是( )
A.![]() B.平衡时M中
B.平衡时M中![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气的主要成分有CO、SO2、氮氧化物等,科学家们-直致力于污染物的有效消除。
(1)利用氨水可以将SO2、氮氧化物吸收,原理如下图所示。
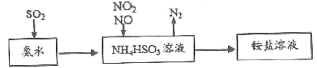
请写出NO2和NO按体积比1:1被吸收时反应的离子方程式_________________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①己知:2NO(g)+O2(g)=2NO2(g) △H1=-113.0kJ· mol-1
2SO2(g)+O2(g)=2SO3(l) △H2=-288.4kJ· mol-1
N2(g)+O2(g)![]() 2NO(g) △H3=+180.5kJ· mol-1
2NO(g) △H3=+180.5kJ· mol-1
请判断反应NO2(g)+SO2(g)=NO(g)+SO3(l) △H4,在低温下能否自发进行_______(填“能”或“否”),理由是__________________________。
②己知TiO2催化尾气降解原理为:
2CO(g)+O2(g)![]() 2CO2(g);2H2O(g)+4NO(g)+3O2(g)
2CO2(g);2H2O(g)+4NO(g)+3O2(g)![]() 4HNO3(g)
4HNO3(g)
i、在一定条件下,模拟CO、NO的降解,得到降解率(即转化率)随时间变化如图所示,
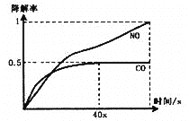
反应40秒后检测到混合气体中N2浓度上升,HNO3气体浓度有所降低,请用化学方程式并结合化学反应原理知识解释可能的原因____________________________________________。
ii,沥青混凝土也可降解CO。如图为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合图表回答下列问题:

已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L-1,求此温度下CO降解反应的平衡常数____________________(用含x的代数式表示);以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10~60℃范围内进行实验,请在图中用线段与阴影,仿照“示例”描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(示例:![]() )_____________________。
)_____________________。
(3)利用如图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2,b极的电极反应式为_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定容积的密闭容器中,放入amolX,发生反应:2X![]() Y(g)+Z(s),并达到平衡状态,此时升高温度,气体的密度增大。下列叙述正确的是
Y(g)+Z(s),并达到平衡状态,此时升高温度,气体的密度增大。下列叙述正确的是
A.平衡后移走部分Z,平衡正向移动
B.若X为非气态,则正反应为放热反应
C.若正反应为放热反应,则X一定为气态
D.若X为气态,再向容器中充入amolX,达到平衡后,X的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com