
分析 由题意可知,NaCN溶液与Au以及空气中的氧气反应,Na[Au(CN)2]( 二氰合金酸钠)溶液,利用元素守恒可书写化学方程式,根据电子得失守恒可计算出消耗的锌与生成的金的物质的量之比,以此来解答.
解答 解:题意可知,NaCN溶液与Au以及空气中的氧气反应,Na[Au(CN)2]( 二氰合金酸钠)溶液,反应的化学方程式为4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,O元素的化合价降低,则为氧化剂,还原1mol金要转移1mol电子,而每mol锌能转移2mol电子,所以消耗的锌与生成的金的物质的量之比为1:2,
故答案为:O2;1:2.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化及电子守恒为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2→H2CO3 | B. | Al(OH)3→Al2O3 | C. | Na2O2→Na2CO3 | D. | SiO2→H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2,H2S,SO2 | B. | N2,Cl2,HBr | C. | CO2,O2,NO | D. | NH3,CO2,HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤、蒸发、蒸馏、萃取 | B. | 过滤、蒸馏、蒸发、萃取 | ||
| C. | 蒸发、蒸馏、过滤、萃取 | D. | 萃取、蒸发、蒸馏、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用图装置验证化学能转化为电能 | B. |  用图装置量取15.00mL KMnO4溶液 | ||
| C. | 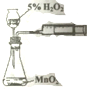 用图装置测定该化学反应速率 | D. | 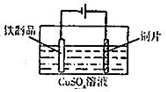 用图装置在铁制品表面镀铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com