
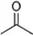
 根据键线式回答下列问题:
根据键线式回答下列问题: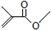 分子式:C5H8O2,
分子式:C5H8O2,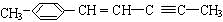 分子中最多有4个原子共直线;
分子中最多有4个原子共直线;
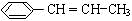 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式: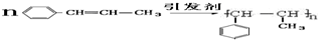 .
. 分析 (1)根据该有机物的键线式判断含有的元素名称及数目,然后写出其分子式;
(2)C≡C为直线型,C=C、苯环为平面结构;
(3)该有机物为为烷烃,根据烷烃的命名原则对该有机物进行命名;
(4)主链为丁烯,根据烯烃的系统命名法写出该有机物的结构简式;
(5)苯丙烯含有碳碳双键,可发生加聚反应生成聚苯乙烯.
解答 解:(1)键线式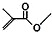 中含有5个C、8个H和2个氧原子,该有机物分子式为:C5H8O2,故答案为:C5H8O2;
中含有5个C、8个H和2个氧原子,该有机物分子式为:C5H8O2,故答案为:C5H8O2;
(2)因C≡C为直线型,直接相连的C在同一直线上,则最多4个C共直线,故答案为:4;
(3)CH3CH(C2H5)CH(CH3)2的主链中最长碳链为5个碳原子,主链为戊烷,从离甲基最近的一端编号,在2、3号C各含有应该甲基,该有机物命名为:2,3-二甲基戊烷,
故答案为:2,3-二甲基戊烷;
(4)顺-2丁烯,主链为丁烯,两个甲基位于双键的同侧,结构简式为: ,故答案为:
,故答案为: ;
;
(5)苯丙烯中含C=C,可发生加聚反应,该加聚反应为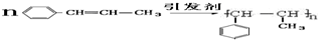 ,
,
故答案为: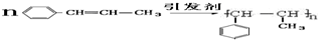 .
.
点评 本题考查有机物的结构与性质,涉及知识点较全,注意把握命名、结构及物质的性质即可解答,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键比范德华力强,所以它属于化学键 | |
| B. | 分子间形成的氢键使物质的熔点和沸点升高 | |
| C. | 由于NH3和H2O之间可形成分子间氢键,使氨在水中溶解度增大 | |
| D. | H2O是一种稳定的化合物,这是由于H2O之间形成氢键所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 卤素 | 氰 | 硫氰 | ① | |
| “单质” | X2 | (CN)2 | (SCN)2 | (OCN)2 |
| 酸 | HX | HCN | ② | HOCN |
| 盐 | KX | KCN | KSCN | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn+Ag2O+H2O═Zn(OH)2+2Ag | B. | Pb+PbO2+2H2SO4═2PbSO4+2H2O | ||
| C. | Zn+CuSO4═Cu+ZnSO4 | D. | CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
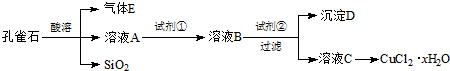
| 离子种类 pH | Fe3+ | Cu2+ | Fe2+ |
| 开始沉淀 | 2.7 | 5.4 | 8.1 |
| 沉淀完全 | 3.7 | 6.9 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
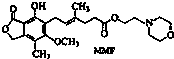 霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物,结构简式如下.下列关于MMF说法中不正确的是( )
霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物,结构简式如下.下列关于MMF说法中不正确的是( )| A. | MMF既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2反应发生取代 | |
| B. | 1molMMF能与含3molNaOH的水溶液完全反应 | |
| C. | MMF即可以催化加氢,又可以使酸性高锰酸钾溶液褪色 | |
| D. | MMF既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com