
【题目】A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。
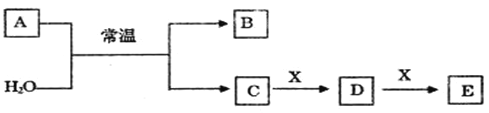
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:____________________________________________________________。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则:
①组成单质A的元素在周期表中的位置为_____________________________________。
②X可能为__________________(填代号)。
A.NaHCO3b.Na2CO3 C.Na2SO3 D.Al(OH)3
(3)若A为淡黄色粉末,回答下列问题:
①A与H2O反应的氧化产物为_____________。
②若X为非金属单质,通常为黑色粉末,写出E的化学式______________。
③若X为一种造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为______(填代号)。
A.盐酸 B.BaCl2溶液 C.NaOH溶液 D.Ca(OH)2溶液
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。
①A与H2O反应的化学反应方程式为__________________________________。
②检验溶液D中还可能存在Fe2+的方法是_________________________________(注明试剂、现象)。
【答案】OH-+HSO3-=SO32-+H2O 第三周期ⅦA族 bc O2 CO a b 3NO2+H2O=2HNO3+NO 取D中适量溶液置于洁净试管中,滴加几滴酸性高锰酸钾溶液,充分反应后褪色,证明溶液中含有亚铁离子,否则无
【解析】
(1)若A为常见的金属单质,焰色反应呈黄色,应为Na,X能使品红溶液褪色,应为SO2,则B为H2,C为NaOH,D为Na2SO3,E为NaHSO3,则C和E反应的离子方程式为OH-+HSO3-=SO32-+H2O。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,应为Cl2,则B为HClO,C为HCl。①Cl原子核外有3个电子层,最外层电子数为7,位于周期表第三周期ⅦA族;
②C为盐酸,可与NaHCO3反应生成CO2,CO2与NaHCO3不反应,a项错误;盐酸与Na2CO3反应生成CO2,CO2与Na2CO3反应可生成NaHCO3,b项正确;盐酸与Na2SO3反应生成SO2,SO2与Na2SO3反应可生成NaHSO3,c项正确;盐酸与氢氧化铝反应生成氯化铝,氯化铝与氢氧化铝不反应,d项错误,答案选bc。
(3)若A为淡黄色粉末,应为Na2O2。
①Na2O2与H2O反应生成氢氧化钠和氧气,一部分氧元素的化合价由-1价降低到-2价,NaOH是还原产物另一部分的氧元素的化合价由-1价升高到0价,氧气是氧化产物。
②若X为非金属单质,通常为黑色粉末,应为C,则D为CO2,E为CO。
③若X为一种造成温室效应的气体,应为CO2,则C为NaOH,D为Na2CO3,E为NaHCO3,鉴别等浓度的D、E两种溶液,可用盐酸或氯化钡溶液,答案为ab。
(4)若A为氧化物,X是Fe,由转化关系可知C具有强氧化性,则A为NO2,B为NO,C为HNO3,
①NO2与水反应的方程式为3NO2+H2O=2HNO3+NO。
②Fe2+具有还原性,可与酸性高锰酸钾发生氧化还原反应而使高锰酸钾褪色,则可用高锰酸钾溶液检验,操作为取D中适量溶液置于洁净试管中,滴加几滴酸性高锰酸钾溶液,充分反应后褪色,证明溶液中含有亚铁离子,否则无。


科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到相应实验目的的是
选项 | 实验目的 | 实验操作 |
A | 探究I-与Fe2+的还原性强弱 | 向FeCl3稀溶液中依次加入KI溶液、淀粉 |
B | 探究HPO42-在水溶液中的电离程度与水解程度的相对大小 | 测定0.1 mol·L-1NaH2PO4溶液的pH |
C | 配制0.1 mol·L-1邻苯二甲酸氢钾( | 称取5.1 g邻苯二甲酸氢钾于烧杯中,加入少量蒸馏水溶解,转移至500 mL容量瓶中定容 |
D | 比较CaCO3和CaSO4的Ksp大小 | 向澄清石灰水中滴入0.1 mol·L-1Na2CO3溶液至不再有沉淀产生,再滴加0.1 mol·L-1Na2SO4溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g),若将1 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数不可能为a的是
2NH3(g),若将1 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数不可能为a的是
A. 2 mol NH3B. 1 mol N2、3 mol H2和2 mol NH3
C. 0.5 mol N2、1.5 mol H2和1 mol NH3D. 0.1 mol N2、0.3 mol H2和1.8 mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰(CN)2的结构简式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间。下列有关反应的化学方程式不正确的是( )
A. (CN)2+H2=2HCN
B. MnO2+4HCN=Mn(CN)2+(CN)2↑+2H2O
C. 向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2
D. 在NaBr和KCN混合液中通入少量Cl2:Cl2+2KCN=2KCl+(CN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧瓶中各盛有100mL 3mol·L-1的盐酸和氢氧化钾溶液;向两烧瓶中分别加入等质量的铝粉,反应结束测得生成的气体体积甲∶乙=2∶3(相同状况),则加入铝粉的质量为( )
A. 2.7g B. 3.6g C. 5.04g D. 4.05g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐(3PbO·PbSO4·H2O,相对分子质量为990)可用作聚氯乙烯的热稳定剂, 不溶于水。以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。

已知:Ksp(PbSO4)=1.82×l0-8;Ksp(PbCO3)=l.46×l0-13。
回答下列问题:
(1)加Na2CO3溶液转化的目的是_________.
(2)酸溶时,不直接使用H2SO4溶液的原因可能是________;铅与硝酸在酸溶过程中发生反应的离子方程式为__________.
(3)流程中可循环利用的物质是_________;洗涤操作时,检验沉淀是否洗涤干净的方法是________。
(4)当沉淀转化达平衡时,滤液l中c(SO42-)与c(CO32-)的比值为_____________。
(5) 50-60℃时合成三盐的化学方程式为______;若得到纯净干燥的三盐99.0t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g) ![]() C(g)+D(g),已达到平衡状态的是( )
C(g)+D(g),已达到平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A. ①②③④⑤⑥⑦⑧B. ①③④⑤
C. ①②③④⑤⑦D. ①③④⑤⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低合金高强度钢是支撑"鸟巢"的铁骨钢筋,除含有铁元素外,还含有Mn(锰),Ti(钛),(铬),(铌)等合金元素,下列有关说法正确的是( )
A. Fe位于元素周期表的第四周期,第VIIIB族
B. 46TiO、 48TiO、50TiO互为同位素
C. Mn 2O7是酸性氧化物
D. ![]() 原子核内有个51个中子,核外有 41个电子
原子核内有个51个中子,核外有 41个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com