
| A. | ②④①③⑤ | B. | ④②①⑤③ | C. | ⑤③①④② | D. | ②④⑤①③ |
分析 根据酸和碱能够抑制水的电离,能水解的盐促进水的电离进行分析.
解答 解:酸和碱均抑制水的电离,能水解的盐能促进水的电离,因此①②④均抑制水的电离,由水电离出的c(H+)均小于1.0×10-7mol/L,其中Ba(OH)2为二元碱,抑制作用最强,因此由水电离出的c(H+)最小,CH3COOH是弱酸,抑制作用最弱,因此由水电离出的c(H+):①>④>②,③和⑤促进水的电离,由水电离出的c(H+)均大于1.0×10-7mol/L,且Na2CO3水解程度强于CH3COONa,因此由水电离出的c(H+):⑤>③.综上可得,则这几种溶液中有水电离出来的氢离子浓度由小到大的顺序为:②④①③⑤,故选A.
点评 本题通过比较有水电离出来的氢离子浓度的大小,考查了盐类水解.电解质的电离等知识,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 红热的铁丝在氯气中燃烧产生棕色的烟雾 | |
| B. | 含有氯元素的物质都呈黄绿色 | |
| C. | 氢气在氯气中燃烧时火焰呈淡蓝色,在瓶口有白雾产生 | |
| D. | 钠在空气里加热,先熔成小球,剧烈燃烧,产生黄色火焰,生成淡黄色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
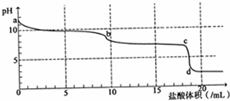 常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )| A. | a点时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-) | |
| B. | 当盐酸加入5mL时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) | |
| C. | 当盐酸加入10mL时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | b-c段发生的反应为:HCO3-+H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c (Cl-)>c(Ac-)>c(HAc)>c(H+) | B. | c(Ac-)+c(HAc)=0.1mol/L | ||
| C. | c (Na+)>cH+)>c(Ac-)>c(OH-) | D. | c(Na+)+c (H+)=c(Ac-)+c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )
近年来研究表明高铁酸盐在能源、环境保护等方面有着广泛的用途.我国学者提出在浓NaOH溶液中用电化学方法来制备高铁酸盐[FeO42-],电解装置如图.下列说法中不正确的是( )| A. | 铅蓄电池是一种二次电池 | |
| B. | 电解时,阳极区溶液的PH不变 | |
| C. | 当阴极收集到0.15mol气体时,可获得0.05molNa2FeO4 | |
| D. | 当阴极收集到0.15mol气体时,铅蓄电池中消耗0.3molH2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 平衡时,分离出少量D,A的转化率提高 | |
| C. | 平衡时,升高温度,容器内混合气体的密度减小 | |
| D. | 平衡时,充入C,该反应平衡常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
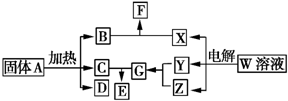 如图所示的无机物的转化关系中,部分生成物和反应条件已略去.其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子.
如图所示的无机物的转化关系中,部分生成物和反应条件已略去.其中A与F是两种酸式盐;常温下B、C、Y、Z是气体,且B能使Z的水溶液褪色;E是一种常见的化肥;X中含有20个电子. ;E中含有的化学键类型是离子键和共价键.
;E中含有的化学键类型是离子键和共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向次氯酸钙溶液中通入过量CO2:2ClO-+Ca2++H2O+CO2═2HClO+CaCO3↓ | |
| C. | 向含0.015 molNaOH的溶液中通入0.64 g SO2:3OH-+2SO2═SO32-+HSO3-+H2O | |
| D. | 向Fe(OH)2中加入足量稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com