
【题目】铝广泛应用于航空、建筑、汽车等行业,目前工业上采用电解氧化铝和冰晶石(Na3AlF6)混合物的方法制取铝。回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图
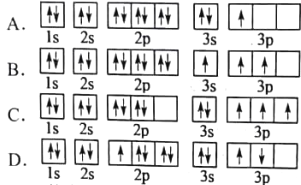
其中能量最低的是___________(填字母),电子由状态C到状态B所得原子光谱为___________光谱(填“发射”或“吸收”),状态D是铝的某种激发态,但该电子排布图有错误,主要是不符合____________________________________________。
(2)熔融状态的氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示。
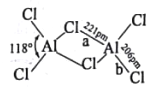
①a键的键能_________b键的键能(填“>”“<”或“=”),其理由是______________________。
②Al2Cl6中铝原子的杂化方式为___________;AlCl3的空间结构为 ___________________。
(3)冰晶石属于离子化合物,由Na+和AIF63-组成,在冰晶石的晶胞中,AlF63-占据的位置相当于氯化钠晶胞中Cl-的位置。
①冰晶石的化学式为___________,一个冰晶石晶胞中Na+的个数为___________。
②已知冰晶石的密度为2.95g/cm3,则冰品石晶胞的边长a=___________pm(列出算式即可,阿伏加德罗常数值为6.02×1023)
【答案】A 发射 洪特规则 < 共价键的键长越短,键能越大 sp3 平面三角形 Na3AIF6 12 ![]()
【解析】
本题主要考查电子排布式特点、原子的杂化方式、分子空间构型的分析、以晶胞为单位的密度计算等知识点。
(1)根据能量最低原理,核外电子先占据能量低的原子轨道,原子轨道的能量由低到高的顺序为1s<2s<2p<3s<3p。根据电子排布的特点,只有A符合能量最低原理;电子由高能级向低能级转变时产生的光谱是发射光谱;洪特规则是指当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。状态D不符合这一规则。
(2)①因为共价键的键长越短,键能越大,b键的键长较大,所以a键的键能小于b键的键能;
②Al2Cl6中每个铝原子和四个氯原子形成4个共价键,采取sp3杂化;AlCl3中Al只形成三个共价键,中心原子Al是sp2杂化,三氯化铝的分子构型为平面三角形结构;
(3)①由化合价代数和为0可知,冰晶石的化学式为Na3AIF6;AlF63-占据的位置相当于氯化钠晶胞中Cl-的位置,因为一个NaCl晶胞中含有4个Cl-,故一个冰晶石的晶胞中含有4个AlF63-,故一个晶胞中含有12个Na+;
②一个冰晶石的晶胞中含有4个Na3AIF6,Na3AIF6的分子量为210,由![]() 得
得![]()
![]() pm。
pm。


科目:高中化学 来源: 题型:
【题目】工业用空气氧化(NH4)2SO3的方法制取(NH4)2SO4,研究小组用如图装置模拟该过程,并通过测定反应后溶液中SO32-的浓度来计算该反应的转化率。

实验步骤
①按图连接好装置,检查气密性;
②取200mL0.5000mol/L的(NH4)2SO3溶液(含有一定量氨水,pH=8)装入三颈烧瓶中,加入催化剂,控制气体流速为300L/h,控制温度在50℃进行实验;
③反应2.5小时后,测定反应后溶液中SO32-的浓度。
回答下列问题:
(1)仪器a的名称是____________________________________________。
(2)装置B的作用是_______________________________________________________。
(3)C中(NH4)2SO3被氧化,该反应的离子方程式为______________________;装置C中的反应需要控制溫度在50℃,采用的实验措施是______________________;C中溶液的pH不能低于8,原因是____________________________________________。
(4)取20.00mL反应后的溶液于碘量瓶中,滴入3滴淀粉溶液,用0.1000mol/L的标准碘溶液滴定至终点,消耗碘水体积为18.50mL,则(NH4)2SO3的转化率为_____________________。
(5)指出实验装置存在的缺陷_________________________________(写一条)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,将10mL 0.1mol/L Na2S2O3溶液和10mL 0.1mol/L的H2SO4溶液混合,2min后溶液中明显出现浑浊。已知温度每升高10℃,化学反应速率增大到原来的2倍,那么50℃,上述反应要看到同样的浑浊,需要的时间是
A. 48s B. 40s C. 20s D. 15s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物参与雾霾的形成,利用CO和H2在一定条件下可将NO转化为无害物质。回答下列问题:
(1)汽车气缸中发生复杂的化学反应,其中有如下三个重要反应:
反应1:N2(g)+O2(g)![]() 2NO(g) △H=+180.5kJ/mol
2NO(g) △H=+180.5kJ/mol
反应2:2CO(g)![]() 2C(s)+O2(g) △H=+221 kJ/mol
2C(s)+O2(g) △H=+221 kJ/mol
反应3:C(s)+O2(g)![]() CO2(g) △H=-393.5 kJ/mol
CO2(g) △H=-393.5 kJ/mol
①反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)的△H=___________。
N2(g)+2CO2(g)的△H=___________。
②下列有关反应1的说法中正确的是___________。
A.反应物的总键能小于生成物的总键能
B.正反应的活化能大于逆反应的活化能
C.使用催化剂可使反应1的反应热减小
D.其它条件不变,加压,正逆反应速率不变,平衡不移动
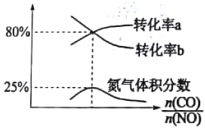
③定温定容条件下,向容积为1L的密闭容器中充入一定量的NO和CO的混合气体(总物质的量保持4mol),平衡时NO、CO的转化率及N2的体积分数与![]() 的关系如图所示,CO转化率对应的曲线为___________(填“转化率a”或“转化率b”,氮气体积分数25%时该反应的平衡常数K=___________,初始时n(NO)=___________.
的关系如图所示,CO转化率对应的曲线为___________(填“转化率a”或“转化率b”,氮气体积分数25%时该反应的平衡常数K=___________,初始时n(NO)=___________.
(2)1073K时,H2与NO可发生反应2NO(g)+2H2(g)![]() N2(g)+2H2O(g),该反应的正反应速率方程为:v=kca(H2)×cb(NO)(a、b分别为H2和NO的级数,k为速率常数)。
N2(g)+2H2O(g),该反应的正反应速率方程为:v=kca(H2)×cb(NO)(a、b分别为H2和NO的级数,k为速率常数)。
在定容容器中,分别充入不同浓度的NO和H2,测得该反应的正反应速率如下表所示:
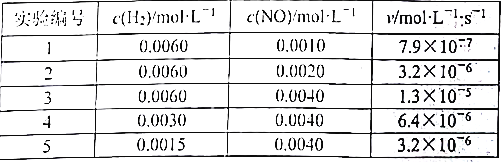
利用上表数据可确定a=___________(保留整数),b=___________(保留整数),k=___________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液体积比为3:2:1时,三种溶液中Cl﹣的物质的量之比为
A. 3:4:3B. 1:2:3C. 3:2:1D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )

A. 微生物促进了反应中电子的转移
B. 正极反应中有CO2生成
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 44gCO2与C3H8的混合物中含有共用电子对数为9NA
B. 将标准状况下2.24LSO2通入水中完全溶解,溶液中HSO32-与SO32-总数为0.1NA
C. 硝酸与铜反应得到NO2、N2O4共23g,则铜失去的电子数为0.5NA
D. 标准状况下,8.96L的平均相对分子质量为3.5的H2与D2混合物中含中子数0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法错误的是
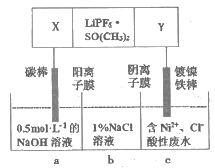
A. 电极Y应为Li
B. X极反应式为FeS+2Li++2e-=Fe+Li2S
C. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com