
【题目】I.乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精。为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
①部分物质的沸点:
物质 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
沸点/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
②乳酸乙酯易溶于苯、乙醇;水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发。
该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下:
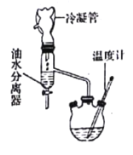
第一步:在反应容器中加入0.1 mol无水乳酸、45.0 mL(密度:0.789g/cm3)无水乙醇、一定量的苯和沸石……;装上油水分离器和冷凝管,缓慢加热回流2 h至反应完全。
第二步:将反应容器中液体倒入盛有适量5%Na2CO3溶液的烧杯中,搅拌并分出有机相后,再用水洗。
第三步:将无水CaCl2加入到水洗后的产品中充分静置,过滤、蒸馏,得产品7.08 g。
(1)第一步操作中,还缺少的试剂是______________________;加入苯的目的是_________________;实验过程中,若油水分离器中水层不再增厚,则表明___________________________________。
(2)第二步中证明“水洗”已经完成的实验方案是_______________________________ 。
(3)本实验制备乳酸乙酯的产率为_________________________。
Ⅱ.磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强,易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05m·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:
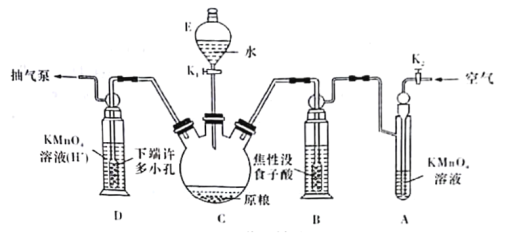
(操作流程)安装吸收装置![]() PH3的产生与吸收
PH3的产生与吸收![]() 转移KMnO4吸收溶液
转移KMnO4吸收溶液![]() 亚硫酸钠标准溶液滴定。
亚硫酸钠标准溶液滴定。
(实验装置)C中盛100 g原粮,D中盛有20.00mL 1.12×10-4 mol·L-1KMnO4溶液(H2SO4酸化)。请回答下列问题:
(4)仪器C的名称是______________;检查整套装置气密性的方法是___________________________________________________________________________。
(5)A中盛装KMnO4,溶液的作用是除去空气中的还原性气体;B中盛装焦性没食子酸的碱性溶液.其作用是______________________________。D中PH3被氧化成磷酸,所发生反应的离子方程式为____________________________________________。
(6)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5 mol·L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗标准Na2SO3溶液11.00 mL,则该原粮中磷化物(以PH3计)的含量为_________________________mg·kg-1。
【答案】浓硫酸 形成水、乙醇和苯的共沸物,分离反应生成的水,促进酯化反应正向进行 酯化反应达到平衡 测定水洗液的pH至7 60% 三颈烧瓶 关闭K1打开K2后,打开抽气泵抽气,观察各装置中是否有气泡产生 吸收空气中的O2,防止氧化装置C中生成的PH3 5PH3+8MnO4-+24H+=5H3PO4+8Mn2++12H2O 0.0085
【解析】
I.(1)酯化反应过程中要用浓硫酸作催化剂和吸水剂;水、乙醇和苯形成共沸物,分离反应生成的水,能促进反应向正向进行;油水分离器中液体不再发生变化,说明反应已经达到了平衡状态;
(2)水洗的目的主要是除去作催化剂的浓硫酸,洗涤液呈酸性;
(3)根据无水乙醇与无水乳酸的反应可知,参与反应的无水乙醇过量,利用乳酸的物质的量计算出生成的乳酸乙酯的物质的量,并进一步计算得到理论上生成乳酸乙酯的质量,最后就算出产率;
Ⅱ.C中盛有原粮100g,D中盛有20.00mL 1.12×10-4 mol·L-1KMnO4溶液(H2SO4酸化),吸收生成的PH3,B中盛装的是没食子酸的碱性溶液,其作用是吸收空气中的O2,防止氧化装置C中生成的PH3,A中盛装的KMnO4溶液的作用是除去空气中的还原性气体;
(4)根据装置图确定仪器C的名称;根据连续装置中的压强的变化分析检查气密性的方法;
(5) B中盛装的是没食子酸的碱性溶液,其作用是吸收空气中的O2,防止氧化装置C中生成的PH3;PH3被氧化成磷酸,高锰酸钾被还原为Mn2+,结合电荷守恒和原子守恒书写离子方程式;
(6)根据消耗的Na2SO3标准溶液的物质的量再结合定量关系计算出剩余的高锰酸钾的量,进一步计算出吸收PH3需要的高锰酸钾的物质的量,而后计算出PH3的物质的量,从而得到其含量。
I.(1)酯化反应过程中要用浓硫酸作催化剂和吸水剂,因此第一步操作中,缺少的试剂是浓硫酸;酯化反应是可逆的,混合物中添加苯可形成水、乙醇和苯的共沸物,分离反应生成的水,能促进反应向正向进行;油水分离器中液体不再发生变化,说明反应已经达到了平衡状态;
(2)最后一次洗涤液不显酸性,可说明洗涤完全,因此只需要测定最后一次的水洗液的pH至7;
(3)根据无水乙醇与无水乳酸的反应可知,参与反应的无水乙醇过量,利用乳酸的物质的量可计算出生成的乳酸乙酯的物质的量为0.1mol,其质量为0.1mol×118g/mol=11.8g,因此制备乳酸乙酯的产率为![]() ×100%=60%;
×100%=60%;
Ⅱ. (4)根据装置图可知仪器C为三颈烧瓶;根据连续装置中的压强变化,可以利用抽气泵抽气,观察各装置中气体的产生,若有气泡冒出,证明气密性良好;
(5) 没食子酸的碱性溶液,其作用是吸收空气中的O2,防止氧化装置C中生成的PH3;PH3被氧化成磷酸,高锰酸钾被还原为Mn2+,离子方程式为:5PH3+8MnO4-+24H+=5H3PO4+8Mn2++12H2O;
(6) 滴定过程中发生的反应为2KMnO4+5Na2SO3+3H2SO4=2MnSO4+K2SO4+5Na2SO4+3H2O,根据反应方程式可知剩余的KMnO4的物质的量为5.0×10-5 mol·L-1×11.00×10-3L×![]() =2.2×10-7 mol;与PH3反应的KMnO4的物质的量为20.00×10-3L ×1.12×10-4 mol·L-1-2.2×10-7 mol×
=2.2×10-7 mol;与PH3反应的KMnO4的物质的量为20.00×10-3L ×1.12×10-4 mol·L-1-2.2×10-7 mol×![]() =4.0×10-8mol,因此吸收的PH3的物质的量为4.0×10-8mol×
=4.0×10-8mol,因此吸收的PH3的物质的量为4.0×10-8mol×![]() =2.5×10-8mol,因此原粮中磷化物(以PH3计)的含量为
=2.5×10-8mol,因此原粮中磷化物(以PH3计)的含量为![]() =0.0085mg/kg。
=0.0085mg/kg。


科目:高中化学 来源: 题型:
【题目】SO2广泛用于医药、硫酸工业等领域,回收废气中的SO2可用如下方法。
方法Ⅰ | 用碱式硫酸铝Al2(SO4)x(OH)y溶液吸收富集SO2 |
方法Ⅱ | 在Fe2+或Fe3+催化下,用空气(O2)将SO2氧化为H2SO4 |
(1)方法Ⅰ的过程如下。
① 制备Al2(SO4)x(OH)y。向Al2(SO4)3溶液中加入CaO粉末,调pH至3.6。 CaO的作用是______
② 吸收:Al2(SO4)x(OH)y吸收SO2后的产物是______(写化学式)。
③ 解吸:加热②中产物,产生SO2,Al2(SO4)x(OH)y再生。
(2)方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化学方程式是______。
(3)方法Ⅱ中,Fe2+的催化过程可表示如下:
ⅰ:2Fe2++O2+SO2=2Fe3++SO42-
ⅱ:……
① 写出ⅱ的离子方程式:______。
② 下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向FeCl2溶液滴入KSCN,无变化
b.向FeCl2溶液通入少量SO2,滴入KSCN,颜色变红。
c.取b中溶液,______。
(4)方法Ⅱ中,催化氧化后,采用滴定法测定废气中残留SO2的含量。将V L(已换算为标准状况)废气中的SO2用1%的H2O2完全吸收,吸收液用如图所示装置滴定,共消耗a mL c mol/L NaOH标准液。

①H2O2氧化SO2的化学方程式______。
② 废气中残留SO2的体积分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol·L-1,某同学进行了如下实验,下列说法正确的是

A. 无法确定原试液中是否含有Al3+、Cl-
B. 原溶液中存在NH4+、Fe2+、Cl-、SO42-
C. 无法确定沉淀C的成分
D. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁稀土合金广泛应用于航空、航天、电子、通讯和汽车制造业等领域。熔盐电解法是一种高效制备镁稀土合金的方法,实验室制取Mg-Gd合金(物质的量比为1:1)的电解槽示意图如下(相对原子质量Mg—24,Gd—157),下列说法正确的是

A.添加LiF、BaF2的作用是催化剂
B.阳极的电极反应式为2F——2e—= F2 ↑
C.当电路中通过0.1mol电子时,生成Mg- Gd合金的质量为3.62 g
D.电解结束后,铝、碳电极质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是 ( )

A.通电后中间隔室的SO42-向阳极迁移,阳极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.阴极反应为4OH--4e-=O2↑+2H2O,阴极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有11.2L O2生成(标况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X、Y,发生反应:mX(g)![]() nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
1L | 2L | 4L | |
100℃ | 1.00mol/L | 0.75mol/L | 0.53mol/L |
200℃ | 1.20mol/L | 0.90mol/L | 0.63mol/L |
300℃ | 1.30mol/L | 1.00mol/L | 0.70mol/L |
下列说法正确的是( )
A.温度不变,压强增大,Y的质量分数减少
B.体积不变,温度升高,平衡向逆反应方向移动
C.m>n
D.Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有机物命名:
![]() ________________________________;
________________________________;
![]() ___________________________________;
___________________________________;
(2)依据名称写出物质:
3,4-二甲基-4-乙基庚烷 ______________;3,4,4-三甲基-1-戊炔 ______________。
(3)已知有机物降冰片二烯的分子结构可表示为: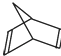
①降冰片二烯的分子式为 ______________;②降冰片二烯属于 __________;
a.环烃 b.不饱和烃 c.烷烃 d.烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
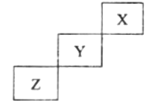
A.非金属性强弱: Z> Y
B.气态氢化物的稳定性: Y>Z
C.最高价氧化物的水化物酸性: Y>Z
D.常压下X的单质化学性质非常活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,并回答下列问题:
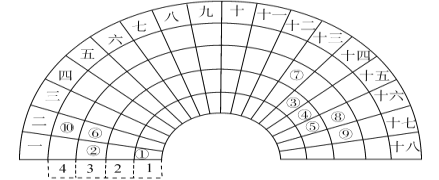
(1)若①~⑩分别代表十种元素,则⑩代表的元素处于常见周期表的位置是_______________________;
(2)⑥⑦为生活中两种常见的金属,其最高价氧化物对应水化物的碱性:⑥____⑦(填>、<或=);比较元素⑧⑨对应的常见单质氧化性的强弱,并用化学方程式证明:____________________________________;
(3)①③⑤三种元素形成的18电子结构化合物是近年来燃料电池研究领域的新宠,写出用它作燃料,②最高价氧化物对应的水化物作为电解质的燃料电池的负极反应式:___________________________;
(4)用电子式表示④的一种10电子结构氢化物的形成过程:_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com