
|
两种金属混合物的质量20 g,与Cl2反应,消耗Cl2 71 g,这两种金属可能是 | |
A. |
钠和铝 |
B. |
铁和镁 |
C. |
钙和铜 |
D. |
铁和铜 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | --- |
查看答案和解析>>
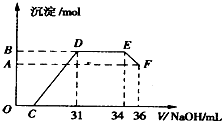
科目:高中化学 来源:化学(高一上)单元同步1+1测试卷 题型:038
由A、B两种金属组成的混合物18g,与足量的盐酸完全反应,分别生成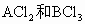 的反应过程中,共收集到1.1mol氢气.已知混合物中A和B的物质的量之比为1∶3,A的相对原子质量为B的相对原子质量的1/3,求A、B的相对原子质量.
的反应过程中,共收集到1.1mol氢气.已知混合物中A和B的物质的量之比为1∶3,A的相对原子质量为B的相对原子质量的1/3,求A、B的相对原子质量.
查看答案和解析>>
科目:高中化学 来源: 题型:
两种金属混合物共重40.0g,在足量氯气中充分反应后,所得固体质量为111.0g。则混合物的组成不可能为
A.Zn、Fe B.Mg、Fe C.Zn、Mg D.Al、Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com