
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A.14gCO、N2混合气体中共含有7NA个电子
B.常温下,0.1mol环氧乙烷(![]() )共有0.3NA个共价键
)共有0.3NA个共价键
C.在含CO![]() 总数为NA的Na2CO3溶液中,Na+总数为2NA
总数为NA的Na2CO3溶液中,Na+总数为2NA
D.氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目为2NA
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】可逆反应mA(g)+ nB![]() pC(g)+qD(g)中,A和D都是无色气体,达到平衡后,下列叙述正确的是( )
pC(g)+qD(g)中,A和D都是无色气体,达到平衡后,下列叙述正确的是( )
A.若增加B的量,平衡体系颜色加深,说明B必是气体
B.增大压强,平衡不移动,说明m+n一定等于p+q
C.升高温度,A的转化率减小,说明正反应是吸热反应
D.若B是气体,增大A的量,A、B的转化率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
Ⅰ | 0.5molI2、0.5molH2 | w(HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
Ⅱ | xmolHI | w(HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=kaw(H2)w(I2),v逆=kbw2(HI),其中ka、kb为常数。下列说法不正确的是( )
A. 温度为T时,该反应![]() =64
=64
B. 容器I中在前20min的平均速率v(HI)=0.025molL-1min-1
C. 若起始时,向容器I中加入物质的量均为0.1mol的H2、I2、HI,反应逆向进行
. 无论x为何值,两容器中达平衡时w(HI)%均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4是两种主要的温室气体。以CH4和CO2为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。
已知:①CH3OH(g) + 3/2 O2(g) = CO2(g) + 2H2O(l) H1= a kJ/mol②H2(g) + 1/2 O2(g) = H2O(l) H2= b kJ/mol ③H2O(g) = H2O(l) H3= c kJ/mol,则CO2和H2反应生成CH3OH和水蒸气的热化学方程式为_____。
(2)用Cu2Al2O4作催化剂制备乙酸。已知:CO2(g)+CH4(g)![]() CH3COOH(g) H2=akJ/mol。
CH3COOH(g) H2=akJ/mol。
①各物质相对能量大小如图所示,则a=___。
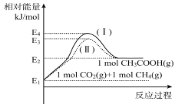
②该反应的速率方程可表示为:v(正)=k正c(CO2)c(CH4)和v(逆)=k逆c(CH3COOH),k正和k逆在一定温度时为常数,分别称作正,逆反应速率常数,请写出用k正,k逆表示的平衡常数的表达式K=___。
(3)将CO2和CH4在一定条件下反应可制得工业合成气,在1 L 密闭容器中通入CH4与CO2,使其物质的量浓度为1.0 mol/L,在一定条件下发生反应:CH4(g) + CO2(g) 2CO(g) + 2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图所示:
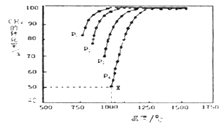
则:
①压强P1,P2,P3,P4由大到小的关系为___。
②对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),如果P4=2 MPa,求x点的平衡常数Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③下列措施中能使平衡体系中c(CO)/c(CO2)减小的是__。
A.升高温度 B.增大压强
C.保持温度、压强不变,充入He D.恒温、恒容,再充入1 mol CO2和1 mol CH4
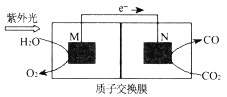
(4)科学家还研究了其他转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,N___极的电极反应式为______,若导线中通过电子为a mol,则M极电解质溶液中H+改变量为___mol,N极电解质溶液m=__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁制品经常进行烤蓝处理,主要目的是在表面生成一层致密的Fe3O4。为了研究烤蓝铁片,把一定量烤蓝铁片加工成均匀粉末,取mg该粉末,放入28.00 mL 1.000mol·L-1的盐酸中,恰好完全反应,生成134.4 mL气体(标准状况)。向反应后的溶液中滴入KSCN溶液,无明显现象。
(1)计算mg样品中n(Fe3O4)=______mol。
(2)写出具体计算过程∶_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表,下列说法正确的是
4NO2(g)+O2(g) ΔH >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表,下列说法正确的是
时间/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/mol·L-1 | 5.00 | 3.50 | 2.50 | 2.50 |
A. 500 s内NO2的生成速率为3.00×10-3 mol·L-1·s-1
B. T1温度下该反应平衡时N2O5的转化率为50%
C. 达平衡后其他条件不变,将容器体积压缩到原来的![]() ,c(N2O5)<5.00 mol·L-1
,c(N2O5)<5.00 mol·L-1
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g) ![]() C(g)+D(g),已达到平衡状态的是( )
C(g)+D(g),已达到平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A. ①②③④⑤⑥⑦⑧B. ①③④⑤
C. ①②③④⑤⑦D. ①③④⑤⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用钛精矿(主要成分TiO2,矿粉中含有Fe,Al,Si,V等氧化物)制备海绵钛的基本思路是:氯化法生产TiCl4、还原、真空蒸馏法制备海绵钛(Ti)。
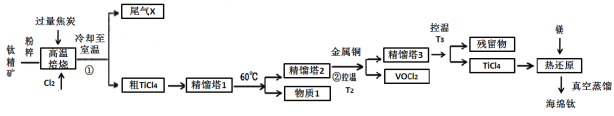
已知:①氯化过程中,其他元素均转化为最高价氯化物;
②热还原过程中,可能会有副产物TiCl3;
③常见物质熔沸点
化合物 | TiCl4 | SiCl4 | FeCl3 | AlCl3 | VOCl3 | VOCl2 | MgCl2 | Ti | Mg |
沸点 | 136 | 56 | 308 | 180(升华) | 134 | 168 | 1412 | 3260 | 1090 |
熔点 | -69 | -25 | 304 | 190 | -78.9 | —— | 712 | 1668 | 648.9 |
回答下列问题:
(1)将钛精矿粉粹的目的是:_______________
(2)氯化过程中,TiO2发生的化学方程式①是:_____________
(3)物质1是________,步骤②中金属铜的作用是将VOCl3还原成VOCl2,其目的是_____________;
(4)工业上常用Mg或H2作还原剂,在Ar气氛下采用热还原法制海绵钛。
①镁不足时,TiCl4会因有副产物产生而导致产率会下降,副反应的化学方程式为_____________;此处采用真空蒸馏法除去海绵钛中的Mg和MgCl2,不采用常压蒸馏的原因是_______。
②根据图象,计算1173K时,反应2H2+TiCl4 =Ti+4HCl的△G=_________。
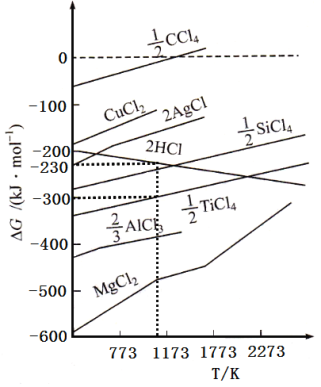
(G为自由能,图中△G是指在一定温度下,由单质生成对应物质的量化合物时的自由能变化。设此温度下,单质的生成自由能变化为0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天津大学某科研团队创新地提出了一种基于电化学冶金原理并利用电解质去耦合策略,在电池中同时进行MnO2和Zn可逆溶解/电沉积的储能机制,其工作原理如图,电池放电总反应为Zn+4OH-+MnO2+4H+![]() Zn(OH)
Zn(OH)![]() +Mn2++2H2O。下列说法不正确的是( )
+Mn2++2H2O。下列说法不正确的是( )
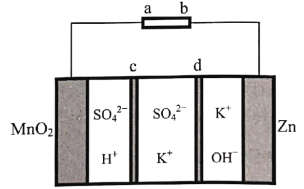
A.充电时,Zn电极区为阴极区
B.c为阴离子交换膜,d为阳离子交换膜
C.放电时,正极电极反应式为MnO2+4H++2e-=+Mn2++2H2O
D.充电时,电子的流向为a→MnO2→电解质溶液→Zn→b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com