
| A. | 分子组成中含碳氢原子个数比为1:2 | |
| B. | 能与溴发生加成反应而使溴水褪色,还能使酸性KMnO4溶液褪色 | |
| C. | 在空气中燃烧能产生黑烟 | |
| D. | 完全燃烧生成等物质的量的CO2和H2O |
分析 A、环烷烃中含碳氢原子数比为1:2,但不含有不饱和键;
B、不饱和键既能与溴发生加成反应,又能被酸性高锰酸钾溶液氧化;
C、燃烧产生黑烟只能说明没有充分燃烧或含碳量高,不能说明含有碳碳不饱和键
D、完全燃烧生产等物质的量的CO2和H2O只能说明该烃中C、H原子比为1:2.
解答 解:A、环烷烃中含碳氢原子数比为1:2,但不含有不饱和键,故A错误;
B、不饱和键既能与溴发生加成反应,又能被酸性高锰酸钾溶液氧化,故B正确;
C、燃烧产生黑烟只能说明没有充分燃烧或含碳量高,不能说明含有碳碳不饱和键,故C错误;
D、完全燃烧生产等物质的量的CO2和H2O,只能说明该烃中C、H原子比为1:2,该烃可能是环烷烃、烯烃,故D错误;故选B.
点评 本题考查了不饱和键的判定,题目难度不大,掌握烃类物质的结构和性质是解题的关键.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SeO3 | B. | HMnO4 | C. | H3BO3 | D. | H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
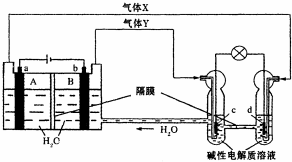 中国首个空间实验室--“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),它是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图,a、b、c、d均为Pt电极.下列说法正确的是( )
中国首个空间实验室--“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),它是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图,a、b、c、d均为Pt电极.下列说法正确的是( )| A. | B区的OH-通过隔膜向a电极移动,A区pH增大 | |
| B. | 图中右管中的OH-通过隔膜向c电极移动,d电极上发生还原反应 | |
| C. | c是正极,电极上的电极反应为:2H++2e-=H2↑ | |
| D. | 当有1mol电子转移时,b电极产生气体Y的体积为11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
| Ⅱ | 800℃ | 1.5 mol | 0.5 mol | -- |
| A. | 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol•L-1•min-1 | |
| B. | 上述方程式中a=-160 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O的沸点比较高,是由于水分子间存在氢键的原因 | |
| B. | 除稀有气体外的非金属元素都能生成不同价态的含氧酸 | |
| C. | 若ⅡA族某元素的原子序数为m,则同周期ⅢA族元素的原子序数可能为m+11 | |
| D. | 由于分子间作用力比化学键弱得多,所以干冰升华容易,而CO2气体分解却不易 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:溴苯>H2O>苯 | |
| C. | 含碳量:甲烷>乙烯>乙炔>苯 | |
| D. | 等物质的量燃烧耗O2量:己烷<环己烷<苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com