
【题目】工业上可采用CH3OH![]() CO+2H2的方法来制取高纯度的CO和H2。我国科研人员通过计算机模拟,研究了在钯基催化剂表面甲醇制氢的反应历程如图所示,其中吸附在钯催化剂表面上的物种用标注。下列说法正确的是( )
CO+2H2的方法来制取高纯度的CO和H2。我国科研人员通过计算机模拟,研究了在钯基催化剂表面甲醇制氢的反应历程如图所示,其中吸附在钯催化剂表面上的物种用标注。下列说法正确的是( )

已知:甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式Ⅰ:CH3OH*→CH3O*+H* Ea=+103.1 kJ·mol-1
方式Ⅱ:CH3OH*→CH3*+OH* Eb=+249.3 kJ·mol-1
A.CH3OH*→CO*+2H2(g)的ΔH>0
B.①②都为O-H键的断裂过程
C.由活化能E值推测,甲醇裂解过程主要历经的方式应为Ⅱ
D.放热最多阶段的化学方程式为CHO*+3H*→CO*+4H*
科目:高中化学 来源: 题型:
【题目】将一定量的二氧化硫和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应2SO2+O2![]() 2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是(填字母)__________________。
a.二氧化硫和三氧化硫浓度相等
b.三氧化硫百分含量保持不变
c.容器中气体的压强不变
d.三氧化硫的生成速率与二氧化硫的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时,消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比____。
(3)若将平衡混合气体的5%通入过量的氯化钡溶液中,生成沉淀的质量是多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吡贝地尔可用于治疗帕金森病,对于控制帕金森病的震颤、运动迟缓、肌张力增高有一定的作用。另外对于不宁腿综合征也有治疗效果。其合成路线如下:
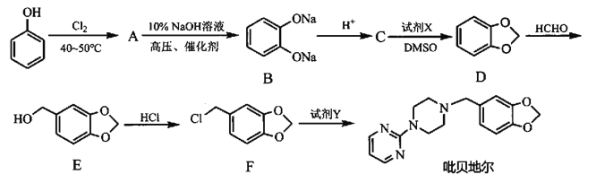
已知:①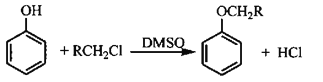
②![]()
回答下列问题:
(1)物质A的结构简式为______,检验A中非含氧官能团所用试剂的先后顺序为____________(填化学式),物质F中含氧官能团的名称为______。
(2)写出C转化为D的化学反应方程式:__________________,D生成E的反应类型为______,试剂Y的结构简式为______。
(3)G与E互为同分异构体,请写出符合下列条件的G的结构简式:______(写出1个即可)。
①遇FeCl3溶液显色 ②能发生银镜反应 ③含有一个手性碳原子
(4)请结合题目中的相关信息,以物质C、1,1-二氯乙烷、乙醛为原料,设计合成 的路线(其他试剂任选)。__________
的路线(其他试剂任选)。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是

A.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图一所示,石墨电极上产生氢气,铜电极发生氧化反应
B.图一所示当有0.1mol电子转移时,有0.1molCu2O生成
C.图二装置中发生:Cu+2Fe3+ = Cu2+ +2Fe2+ ,X极是负极,Y极材料可以是铜
D.如图二,盐桥的作用是传递电荷以维持电荷平衡,Fe3+ 经过盐桥进入左侧烧杯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计了一种智能双模式海水电池,满足水下航行器对高功率和长续航的需求。负极为Zn,正极放电原理如图。下列说法错误的是( )

A. 电池以低功率模式工作时,NaFe[Fe(CN)6]作催化剂
B. 电池以低功率模式工作时,Na+的嵌入与脱嵌同时进行
C. 电池以高功率模式工作时,正极反应式为:NaFe[Fe(CN)6]+e-+Na+=Na2Fe[Fe(CN)6]
D. 若在无溶解氧的海水中,该电池仍能实现长续航的需求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O}(相对分子质量:288)可由乳酸与FeCO3反应制得,它易溶于水,几乎不溶于乙醇,受热易分解,是一种很好的补铁剂。
Ⅰ.制备碳酸亚铁:装置如图所示。
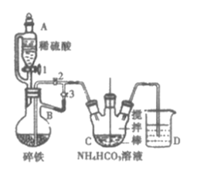
(1)仪器B的名称是___。
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是___,然后打开活塞2,关闭活塞___。
Ⅱ.制备乳酸亚铁:向纯净的FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)该反应化学方程式为___。为防止乳酸亚铁变质,在上述体系中还应加入___,反应结束后,从所得溶液中获得乳酸亚铁晶体的步骤如下,请将前四步正确排序(写字母序号):___,干燥。
a.过滤 b.隔绝空气,加热 c.冷却结晶 d.用适量乙醇洗涤
Ⅲ.乳酸亚铁晶体纯度的测量;
(4)用K2Cr2O7滴定法测定样晶中Fe2+的含量计算样品纯度,称取6.00g样品配制成250.00mL溶液。取25.00mL用0.0100mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为___(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105Pa,298K条件下,1 g氢气燃烧生成水蒸气放出121kJ热量,下列热化学方程式正确的是
A.H2O(g)=H2(g)+![]() O2(g) △H=+242kJ/mol
O2(g) △H=+242kJ/mol
B.2H2(g)+O2(g)=2H2O(l) △H=-484kJ/mol
C.H2(g)+![]() O2(g)=H2O(g) △H=+242kJ/mol
O2(g)=H2O(g) △H=+242kJ/mol
D.2H2(g)+O2(g)=2H2O(g) △H=+484kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L密闭容器中,X、Y、Z三种气态物质发生反应时,物质的量随时间变化的关系曲线如图所示,求:
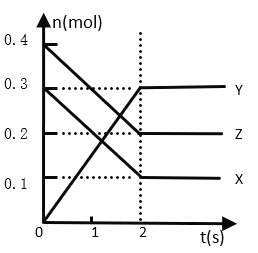
(1)前2 s内X的反应速率_____________。
(2)化学反应方程式___________________。
(3)Z的平衡转化率____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为:![]() ,已知该反应在不同温度下的平衡常数如下:
,已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式![]() ______,该反应的正反应是______反应(填“放热”、“吸热”)。
______,该反应的正反应是______反应(填“放热”、“吸热”)。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率![]() ______、CO的平衡转化率
______、CO的平衡转化率![]() ______;
______;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是______。
a.减少Fe的量 b.增加Fe2O3的量 c.移出部分CO2 d.提高反应温度e.减小容器的容积 f.加入合适的催化剂
(4)在氯氧化法处理含![]() 的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
①某厂废水中含KCN,其浓度为650mg/L。现用氯氧化法处理,发生如下反应(其中N均为![]() 价):
价):![]() 被氧化的元素是______。
被氧化的元素是______。
②投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目:
□![]() □
□![]() □
□![]() □
□![]() □
□![]() □
□![]() □
□![]() ______
______
③若处理上述废水40L,使KCN完全转化为无毒物质,至少需液氯______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com